24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
引言:本文简单介绍如何做医疗器械产品在美国FDA的合规。本来是想要写一个系列,逐步详细介绍FDA合规内容。但是,FDA的网页介绍和Guidance写得实在太好了——我的基本评价是“框架清晰,细节明白”。所以,即使时间允许,我能够写出各个流程的介绍,读者花时间看我的作品,倒真的不如直接去看FDA的原有内容。

那么,我这篇文章能够贡献的又是什么呢?我想有三个方面:
一个是FDA的合规框架。就好像你进入一个领域,逐步摸索,和一下子看到“全局地图”,肯定是后者更有助于项目的推动和发展。
还有就是,基本合规动作的入口。仅仅有一个“地图”还不够用,有些基本的操作,从哪里开始去实操?
最后就是一些关键资源的端口。
了解以上三个方面,然后,具体的内容再能够沉下心来读FDA,一步一步推进项目,是没有大问题的。其实,做很多事情,有这三个方面的基本了解,都是很好的开始了。

首先讲FDA的合规框架。按照上图,一块一块的讲解。
FDA医疗器械注册主要需要两个账号,一个交钱的,一个企业注册的。从架构上,这两个部分放在前面,但是,从操作流程上可以置后。你可以先准备产品注册需要的各种测试报告,或者提交材料,等快到提交了,再申请这两个账号。但是,注意,如果需要申请FDA小企业费用减免,则要打一些提前量。
然后,从上市途径来讲,有PMA,510K,De Novo和EUA。上市审批(PMA)只有III类产品需要做;大部分的II类产品走上市前通知(510K)的途径就可以了,即同类产品对比,证明实质等同(Substantially Equivalent);对于,不知道是哪个类别的产品,可以通过“新”产品(De Novo)的途径请FDA判定;然后,应对紧急情况的可以紧急使用授权(EUA)。III类产品的路径又可以细分为:传统/标准PMA(Traditional PMA),模块化PMA(Modular PMA),产品开发策划(Product Development Protocol,PDP),人道主义使用(Humanitarian Use Device,HUD)。另外,还有一个快速评审的Breakthrough途径。进一步,如果想要理解基本的区别,HUD是针对比较少的患者数量;EUA是针对紧急情况;Breakthrough可以认为是针对突破性的且更为有效的技术。
而FDA对医疗器械的管控则是分为:General Control,Performance Standard,Special Control和PMA。具体说明可以见以下链接:
https://www.fda.gov/medical-devices/overview-device-regulation/regulatory-controls
FDA提供了很多的指南性文件,大致上可以分为流程性指南(比如,如何提交材料,如何判定是否受理,如何评判实质等同),技术性指南(比如,生物兼容性如何做,产品有效期/货架寿命如何做)和质量体系指南(比如,如何做验证和确认,如何做设计开发控制)。
FDA提供了分类目录(Classification Panel),产品编码(Product Code),已上市产品数据库,和各种指南,作为支撑信息。

一般而言,产品获批之后,在正式进入美国之前,要选定美国代理(US Agent),确定产品唯一标识(UDI),并且随时做好准备迎接质量体系审核(可以参看21 CRF 820和C.P. 7382.845)。
对于质量体系审核,FDA大概分为四种:1. 批准前审核Pre-approval Inspection(适用于PMA);2. 一般审核Routine Inspection;3. 不符合再审核Compliance Follow-up Inspection;4. 有因审核"For Cause" Inspection。具体可以阅读如下链接:
https://www.greenlight.guru/blog/types-of-fda-inspections
接下来讲,基本合规动作的入口。
1.邓白氏编码申请(海外公司在注册User Fee账号之前需要先申请邓白氏编码。)
https://www.huaxiadnb.com/duns-registered-solution/duns-application-cn.html

2. 注册缴费。(用邓白氏编码,申请成功之后,生成Organization ID。)
https://userfees.fda.gov/OA_HTML/mdufmaCAcdLogin.jsp

3. 小企业申请。(申请小企业认证可以减免费用。填写表格的时候需要上一步的Organization ID。)
https://www.fda.gov/medical-devices/premarket-submissions/reduced-medical-device-user-fees-small-business-determination-sbd-program
下载Form FDA 3602A表格。打印填写相关信息。另外,需要到所在税务局申请盖章,证明企业收入情况。
4. 企业注册。
https://www.fda.gov/medical-devices/how-study-and-market-your-device/device-registration-and-listing
https://www.fda.gov/medical-devices/device-registration-and-listing/access-electronic-registration
https://www.access.fda.gov/oaa/logonFlow.htm?execution=e1s1

(对于以上四点,也可以参看FDA 网页介绍 How to Register and List)
(https://www.fda.gov/medical-devices/device-registration-and-listing/how-register-and-list)
5.资料提交(电子)
https://www.fda.gov/medical-devices/how-study-and-market-your-device/ecopy-program-medical-device-submissions

6. 产品注册基本分析举例
先从Classification Panel中找到产品的分类编号。
https://www.fda.gov/medical-devices/device-registration-and-listing/access-electronic-registration
比如,玻璃体切割产品。
首先属于,眼科产品,对应到21 CFR 886中。进而对应到886.4150。发现是II类,Special Control。
使用Product Classification数据库查询886.4150。
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPCD/PCDSimpleSearch.cfm
发现其中有6个Produce Code。

再点开具体介绍,看看自己的产品与哪个Product Code相符合。比如,第一个HKP。

打开可以发现更细节信息。比如:提交方式 Submission Type(510K),GMP豁免(No),第三方审核Third Party Review,以及可供选择的第三方Accredited Persons。
既然发现是510K,进而到510K数据库中搜索同类产品。在Product Code栏中输入HKP。
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm
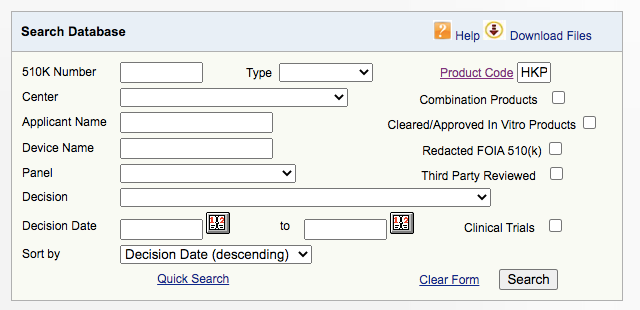

打开第一个Aaron Vac2。如果有510K Summary,就可以下载。
如果产品是需要PMA的,比如,870.3610 Implantable pacemaker pulse generator。则到Product Classification中可以查到如下信息。
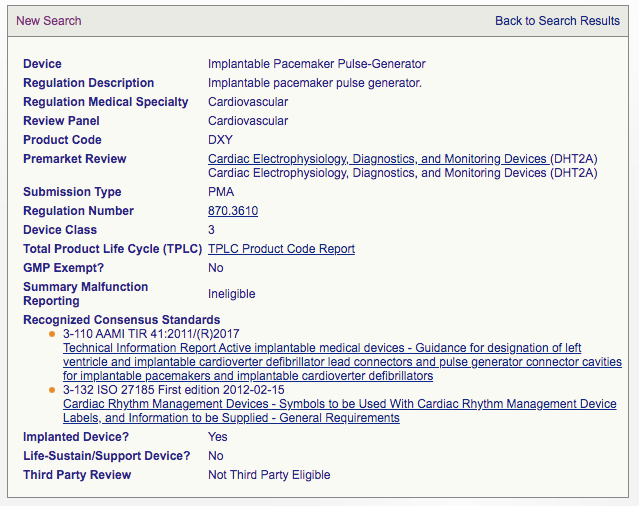
再到PMA数据库中查询同类产品。
以Tendril MRI为例子。
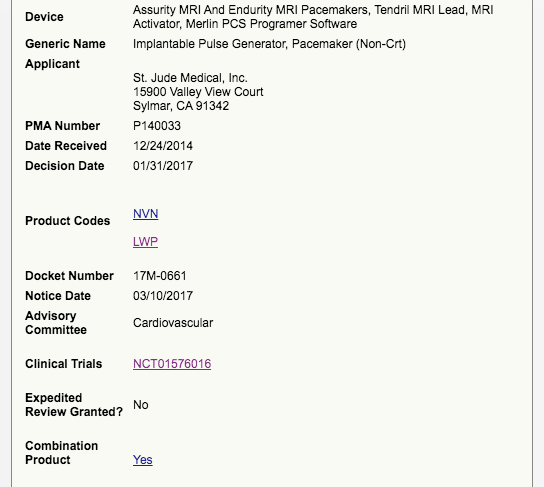
可以查到它的临床试验情况,安全有效性总结,说明书,上市后研究等。

另外,记得要到FDA Guidance数据库里搜索有没有Device-Specific Guidance。比如我们挑选的眼科的这个产品是有第三方审核的指南的。

植入心脏起搏器的这个也有Guidance。

对于有Device-Specific Guidance的产品,应该满足Guidance的相关要求,否则可能在受理的时候被Refuse To Accept - RTA。
(第6点的相关内容,也可以参考FDA 网页介绍 How to Study and Market Your Device)
(https://www.fda.gov/medical-devices/device-advice-comprehensive-regulatory-assistance/how-study-and-market-your-device)

最后是关键资源端口。
1. e-CFR 好用的Code of Federal Regulation的阅读网站。
https://www.ecfr.gov/cgi-bin/text-idx?SID=3ee286332416f26a91d9e6d786a604ab&mc=true&tpl=/ecfrbrowse/Title21/21tab_02.tpl
2. 510K和GMP豁免的产品。
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpcd/315.cfm
3. 510K数据库。(注意可以通过勾选Redacted FOIA 510(k)选项,获得公开的510K审批资料信息。)
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm
4. FDA信息公开网站(FDA Freedom of Information)。
https://foiservices.com/
5. 警告信(Warning Letters)。
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters
6. FDA指南数据库。
https://www.fda.gov/regulatory-information/search-fda-guidance-documents#guidancesearch
7. PMA数据库。
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMA/pma.cfm
8. 企业注册和产品列示数据库。
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
9. 医疗器械数据库集。
https://www.fda.gov/medical-devices/device-advice-comprehensive-regulatory-assistance/medical-device-databases
10. FDA CDRH视频PPT讲解
https://www.fda.gov/training-and-continuing-education/cdrh-learn
11.FDA认可的标准数据库
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfStandards/search.cfm
来源:医疗人咖啡
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。