24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

ISO9001认证体系,可以说是对于企业的一个质量的保障,是很多企业都需要的一个认证,只有获得这个认证,才代表着你的产品质量得到了市场的肯定。能够更好的进行市场的交易。下面小编来介绍一下iso9001认证步骤和流程。
查看详情
ISO9001在大家心里,只感觉是一个很权威的认证。平时我们生活当中会看到喝的饮料还有路过的工厂、以及一些其他的商品上会标记说获得ISO 9001认证?这些认证是由什么机构来
查看详情
在做ISO9001认证的时候也是需要相应的条件的,首先公司的营业时间必须满三个月,还有就是公司必须做过咨询。那么接下来我们一起来看看iso9001认证申请条件和申请流程。
查看详情
申请人提交材料目录:资料编号(一) 境内第三类医疗器械注册申请表;
资料编号(二) 医疗器械生产企业资格证明;
资料编号(三) 产品技术报告;
资料编号(四) 安全风险分析报告;
资料编

iso9001质量体系认证是什么意思?iso9001是指什么?ISO9000是被全球认可的质量管理体系标准。ISO9001:2000是国际标准化组织融合现代管理学最新的理念精华,推出的最新质量管理体系标准,更加适用于各种类型、各种行业的组织。ISO9001:2000为组织提供了一种切实可行的的方法,以体系化模式来管理组织的质量活动,并将“以顾客为中心”的理念贯穿到标准的每一元素中去,使产品或服务可持续地符合顾客的期望,从而拥有持续满意的顾客。
查看详情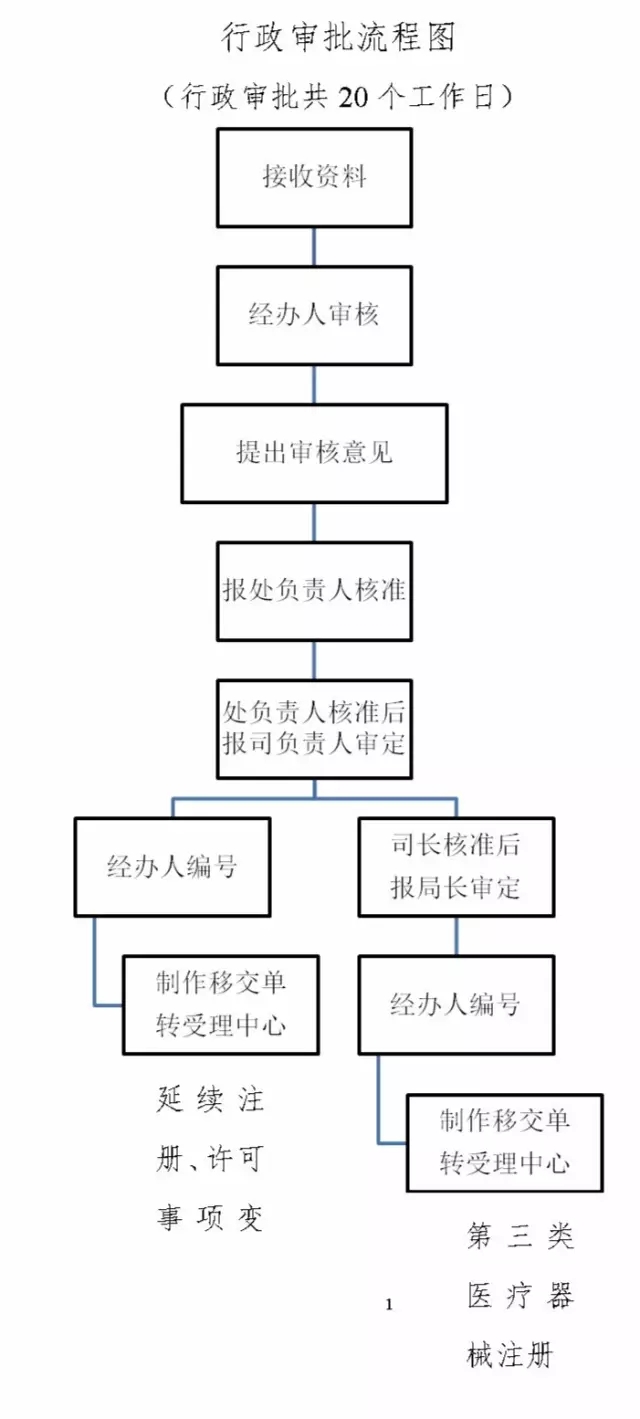
国产第三类医疗器械首次注册审批流程国产第三类医疗器械首次注册审批一、适用范围 本指南适用于的申请和办理国产第三类医疗器械首次注册。二、项目信息 (一)项目名称
查看详情
常见的6类玩具CCC认证范围限定:1、童车类:适用于设计或预定供儿童乘骑玩耍的童车产品,包括:儿童自行车(鞍座高度在435mm~635mm范围内)、儿童三轮车、儿童推车、婴儿学步车、玩具自行车(鞍座高度小于435mm)、电动童车、其他玩具车辆。2、电玩具:适用于设计或预定供14岁以下儿童玩耍的、至少有一种功能需要使用电能的玩具产品,包括各种材质的电动玩具、视频玩具、声光玩具等,注:不包括变压器和电池充电器。
查看详情
所有的玩具都需要CCC认证(简称3C认证)吗?
答:根据中国国家质量监督检验检疫总局、国家认证认可监管管理委员会2005年第198号联合公告,已明确对在国内销售的六大类玩具产品实行强制认证的市场准入制度,其余玩具正逐步推进。这六类玩具产品的CCC认证从2006年3月1曰起受理申请,2007年6月1日起开始强制实施。