24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
附件:上市药品临床安全性文献评价指导原则(试行)(2019年第27号).doc
一、概述
国家药品监督管理局《关于药品上市许可持有人直接报告不良反应事宜的公告》(2018年第66号)第四款规定,持有人应当定期对药品不良反应监测数据、临床研究、文献等资料进行评价。上市药品临床安全性文献评价作为药品上市后临床研究的主要方法之一,是指尽可能全面系统地收集一定时间范围内、特定上市药品的临床安全性研究相关文献,在对文献资料进行系统筛选、资料提取、质量评价和归纳整理的基础上,进行定性或定量综合分析评价,并形成评价报告的过程。基本要素包括文献评价的一般流程、方法学要点以及评价报告撰写规范。
本指导原则借鉴了循证医学证据分类、分级、严格评价和不断更新的理念与方法,参考了卫生技术评估综合评价卫生技术的指标与形式,引进了Cochrane系统评价规范化操作流程和全程质量控制的方法,旨在为药品上市许可持有人(以下简称持有人)开展上市药品(包括中药、化学药和生物制品)的临床安全性文献评价和撰写文献评价报告提供指导。
二、方法学要点
(一)一般流程
文献评价一般流程见图1:

1.确定评价目的。根据管理部门的要求或者持有人的自身需求明确研究目的。可采用循证医学PICOS格式明确研究问题,从而准确定位评价目的,使后续工作更有针对性、提高研究效率。PICOS为研究对象(Patient/Population)、干预措施(Intervention)、对照措施(Comparison/Control)、结局指标(Outcome)和研究设计(Study design)英文首字母的组合。
2.制定研究方案。研究方案包括文献纳入标准、文献排除标准、检索策略、文献筛选、原始研究质量评价方案、信息提取方案、统计分析计划、证据等级评价方案以及不良事件术语标准化方案。检索策略包括检索的数据库、检索范围(如主题等)、检索词、检索式(即检索词组合方式)和时间范围等,应当根据不同的研究目的制定。
3.全面查找证据。根据所确定的检索策略,通过各种有效途径(如电子检索/手工检索)全面查找证据。数据资料包括常用数据库、专业数据库、政府网站、会议摘要、学术论文集以及其他未公开发表的文献等,常用数据库和相关网站参见附录(一)。鼓励不限制语种,全面检索中外文数据库。如果在查找证据时限制了发表文献的语种、时限、设计类型等条件,应当在报告中注明。查找时应当注意收集未公开发表的文献,即“灰色文献”,如会议论文、未发表的学位论文、产业报告、咨询报告等。灰色文献中可能包含阴性研究结果,这些结果在通常情况下公开发表的机会较小,若文献评价中只纳入已公开发表的文献会引入发表偏倚。
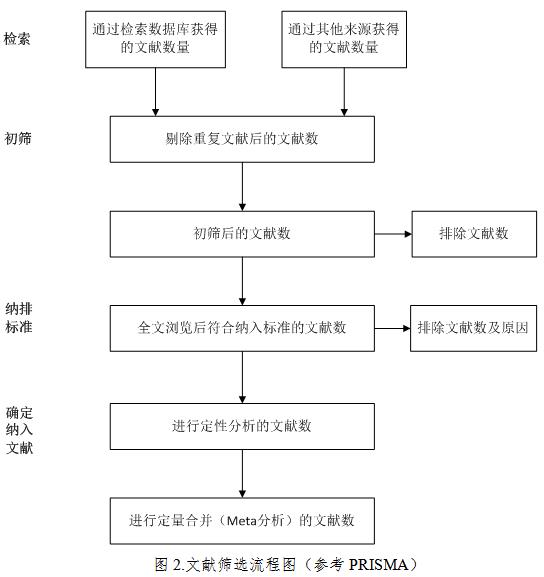
4.文献筛选。根据研究目的确定文献纳入和排除标准,按照纳入和排除标准进行文献筛选(文献筛选流程见图2),应当说明纳入文献的数量、排除文献的数量和理由。文献筛选一般需要进行初步筛选(利用题目和摘要进行初步筛选)和全文筛选(详细阅读全文进行筛选)两个步骤。
5.资料提取。根据研究目的、所关注的问题、拟分析的内容等设计资料提取表,表格内容应当详略得当。资料提取表设计时应当参考循证医学PICOS原则、质量评价方法的相关要求,纳入文献资料提取表参见附录(二)。提取资料主要包括文献一般情况(编号、题目、作者、来源、出版时间等)、研究的PICOS信息、文献质量信息(研究的设计类型和存在的偏倚,如数据收集是否合理,分析的方法是否恰当等)、主要结果资料以及其他信息(如有无持有人资助)等。资料提取表设计完成后应当进行预提取,并根据预提取结果进行适当调整和完善。
6.文献质量评价。文献质量评价是文献研究不可缺少的重要环节,文献质量评价标准参见附录(三)。如果原始文献质量不高,文献评价也难以产生高质量的综合分析结果。文献质量评价包括方法学质量评价和报告质量评价,前者主要涉及偏倚风险评价即原始研究的真实性评价,后者主要涉及报告的完整性和透明性。关于这两个方面,多个组织已经制定了国际公认的、针对不同研究设计的评价量表与清单,研究者应当根据不同研究目的选择恰当工具。
7.资料分析。根据资料的具体情况,采取定性或定量分析方法。定性分析是叙述性汇总入选研究结果的方法,可以采用表格对入选研究的特征和研究结果进行对比和总结。定量分析是应用统计学方法对入选研究结果进行汇总分析,包括异质性检验、Meta分析、敏感性分析以及亚组分析等。当入选研究的异质性较大时,可通过亚组分析和Meta回归探讨异质性来源;如果异质性仍无法降低,则不适合进行定量分析。需要对研究主要结局汇总结果的稳健性进行评价,一般采用敏感性分析的方法。一般不良反应/事件数量相对较低,甚至为“0”。出现这种情况时,可以考虑在做Meta分析时用“0.5”来替代“0”进行计算。若通过文献质量评价发现检索到的原始研究质量普遍不高、偏倚较大、不能满足评价要求或不能解决现有问题,可以调整文献检索策略重新检索新的证据(但必须在最终报告中着重说明),或者根据实际工作需要提出下一步研究计划。
8.形成文献评价报告。文献评价报告应当说明是基于何种级别的证据所获得的结论,同时说明结果的外推性。证据分级标准参见附录(四)。撰写文献评价报告可参考系统综述/Meta分析优先报告的条目(Preferred Reporting Items for Systematic reviews and Meta-Analyses, PRISMA)、流行病学观察性研究的Meta分析(Meta-analysis Of Observational Studies in Epidemiology,MOOSE),PRISMA声明和MOOSE声明参见附录(五)。
(二)安全性文献评价注意事项
1.安全性文献评价应当检索与研究药品有关的所有国内外文献资料,包括以药品安全性为研究目的资料、以药品有效性为主要研究目的资料、正在研究(已获得中期研究结果)或已完成研究但未发表的临床研究(灰色文献)及不良反应个案报道等。
2.安全性文献评价应当重点纳入观察性研究结果。随机对照试验和非随机对照试验也应当纳入。观察性研究包括队列研究、病例对照研究、现况研究、生态学研究、病例系列、病例报告及其他衍生的流行病学研究类型(病例交叉研究、病例—时间—对照研究等)。
3.需结合具体情况评价不同类型研究的质量。评价内容主要考虑研究设计、实施、统计分析和结果报告等,评价时重点关注原始文献可能存在的偏倚及偏倚控制。文献质量评价结果应当在药品安全性文献评价下结论时加以考虑。
4.安全性文献评价的资料提取表除包括文献评价的一般内容外,还应当包括不良反应/事件发生情况描述、用药情况、合并用药情况、不良反应/事件转归、关联性评价等。应当尊重原始研究论文作者对药品不良反应/事件的判断。
5.安全性文献评价可以采用描述性分析方法对安全性资料进行归纳,可采用列表形式报告结果。
6.文献资料中出现的严重不良反应/事件,对于可以获取个例信息的,应当逐例进行详细描述,包括但不限于患者基本人口学特征、病情、诊疗过程、联合用药、发生不良反应/事件的过程、处理方法与结局转归。对于严重病例应当评价资料是否齐全,因果关系是否成立。应当结合因果关系判断原则谨慎分析并做出结论。必须对个案病例进行总结分析。
7.对于企业发起或者资助的上市药品临床安全性文献评价,应当包括药品不良反应监测数据的分析。对于监测数据的分析重在关注药品的安全风险信号。对于个别报告有细节信息(如药品批号)与实际不符的,也不能剔除该报告。应当根据药品不良反应监测相关指南规范药品不良反应名称,对不良反应/事件进行因果关系评价(评价标准参见图3)。基于监测数据的分析,应当分析监测数据与药品说明书安全性信息的差异,分析新的且严重的不良反应的发生情况,讨论是否需要采取风险管理措施并提出获益风险评估的意见。
8.计算不良反应/事件发生率时应当慎重。评价药品安全事件的重要性和影响程度时应当结合不良反应/事件发生率及其严重程度进行综合评价,并对安全性评价结果进行解释。在安全性文献评价的基础上,应当基于药品的有效性,做出药品获益风险评估的综合结论。
9.应当与已经发表的相关系统综述、Meta分析进行比较,包括(但不局限于)纳入和排除标准、纳入文献范围、干预、对照、结局、数据分析方法、结果和结论。

10.应当明确分析本文献评价的优点和局限性。
11.需要提供所有纳入文献清单以及全文筛选阶段被排除的文献清单和排除原因。
(三)质量控制注意事项
1.在正式研究开展之前,应当制定内容完整的研究方案。鼓励持有人严格依据研究方案开展后续研究工作,如与研究方案有出入的应当予以说明。鼓励持有人对研究方案进行注册。
2.鼓励在文献检索、筛选、资料提取、质量评价与数据录入过程由两名评价员独立进行。在文献初筛阶段,如两名筛选员中有一人认为可以纳入,则该文献予以纳入;在文献全文筛选、资料提取和质量评价阶段,如两位独立评价员意见不一致,需要通过协商解决,若无法达成共识,则需由第三方裁决。鼓励记录并评价两位独立评价员在文献筛选、资料提取和质量评价结果的一致性,如kappa值。
3.鼓励尽可能获取所有相关研究信息。若已发表文献不能提供足够信息,如研究方法的重要细节、研究结果的主要数据等,需要联系作者获取相关资料。对于持有人发起或资助的灰色文献,应当纳入研究;应当尽力获取其他灰色文献。
4.鼓励对相关原始资料留存备查,包括但不局限于:检索策略,每个数据库的检索记录(如时间、检索策略、检索结果);文献及题录信息的存储(每个数据库的文献存储),删除重复文献的方法和结果;每位文献筛选员的文献筛选表,汇总并达成共识的文献筛选结果;每位资料提取员的资料提取表,汇总并达成共识的资料提取表;每位质量评价员的质量评价表,汇总并达成共识的质量评价表;与作者、持有人、研究团队进行联系和沟通的原始记录。
三、报告撰写规范
撰写文献评价报告应当遵循一定的规范。“提高医疗卫生研究质量和透明性工作网(Enhancing the Quality and Transparency of Health Research Network, EQUATOR)”官方网站(http://www.equator-network.org/)收集了数百个相关报告指南,其中常用的报告规范有PRISMA声明和MOOSE声明,详见附录(五)。这两个声明都以清单条目形式提供了不同原始研究类型系统评价的报告框架。撰写报告时应当逐一对照清单条目,简洁、清晰、真实、完整地报告各项内容。
文献评价报告的正文部分需涵盖以下内容,报告撰写格式参见附录(六)。
(一)背景及目的
描述选题背景、立题依据(重要性)以及开展此次评价的目的,并根据PICOS原则清晰表达本次研究拟解决的问题。
(二)方法
描述文献纳入和排除标准、检索策略、文献筛选、数据提取、质量评价、资料处理与数据分析。
1.文献纳入和排除标准:纳入和排除的研究类型、研究对象、干预措施、结局指标(包括主要指标、次要指标,应当说明是否为替代指标)。文献排除标准应当在文献纳入标准之上,具体说明哪些研究不符合进一步分析的要求而被排除。
2.文献检索策略:检索途径、检索数据库、检索时限及检索式。应当说明是否有检索限制(如语言限制)、是否手工检索、是否检索灰色文献等关键问题。
3.文献筛选:文献筛选流程、结果与质控,应当说明是否由两名评价者独立进行文献筛选及如何解决分歧。
4.资料提取:交代资料提取方法及所提取的内容,说明是否由两名评价者独立进行资料提取及如何解决分歧。
5.质量评价:描述所用的评价工具/标准或列出参考文献,说明是否由两名评价者独立进行质量评价及如何解决分歧。
6.资料处理与统计分析:描述数据的处理方法。若有定量合成过程,需要说明采用何种合并效应量,说明何种统计分析方法。
(三)结果
描述研究的主要发现。包括文献检索结果、研究特征和质量评价结果、数据合并结果。
1.文献检索结果:描述初检出文献量,最终纳入文献量,绘制文献筛选流程图直观显示逐项排除的文献量及原因。
2.研究特征和质量评价结果。可用表格的形式,直观表达纳入研究的特征以及质量评价结果。研究特征表常用的变量包括纳入研究的年限、地域、样本量、人群、研究类型、干预措施、对照措施、结局指标、效应量与可信区间以及质量评价结果等。
3.数据合并结果:按评价指标逐条整理归纳、报告。定量资料经异质性检验合格,进行合并分析并报告定量分析结果。定性资料可按同质性分类、归纳、整理,并报告分析结果。对于定量合并应当提供合并效应量及可信区间,最好提供森林图。
(四)讨论
讨论是对结果的分析,而不是对结果进行重复描述。讨论应当紧密围绕研究目的进行,一般对以下内容进行讨论:主要结果的产生原因或意义,文献证据质量及其对结果的影响,本评价的质量、偏倚控制及局限性(如是否纳入所有相关研究、是否获得所有相关资料、所采用的方法是否会带来偏倚),本研究结果与其他类似研究或评价结果的异同点,作者结论,提出推荐的证据级别,指出本评价的局限性,以及对今后开展类似研究或者评价的改进建议。
四、本指导原则所依据的参考文献
1.李幼平.实用循证医学.北京:人民卫生出版社,2018.
2.李幼平.循证医学.北京:人民卫生出版社,2014.
3.唐金陵,Paul Glasziou.循证医学基础(第2版).北京:北京大学医学出版社,2016.
4.詹思延.流行病学(第8版).北京:人民卫生出版社,2017.
5.刘建平.循证中医药临床研究方法学.北京:人民卫生出版社,2009年.
6.孙凤.医学研究报告规范解读.北京:北京大学医学出版社,2015.
7.张天嵩,钟文昭,李博.实用循证医学方法学(第2版).长沙:中南大学出版社,2014.
8.张天嵩,董圣杰,周支瑞.高级Meta分析方法——基于Stata实现.上海:复旦大学出版社,2015.
9.Higgins JPT,Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. The Cochrane Collaboration,2011. Available from www.cochrane-handbook.org.
10.Guyatt G,Rennie D,Meade MO,et al. User’s Guides to the Medical Literature:A Manual for Evidence Based Clinical Practice. 3rd Edition. New York:McGraw-Hill Education. 2015.
五、附录
(一)常用数据库和相关网站
1.数据库举例:
(1)Cochrane数据库:http://www.cochranelibrary.com/,http://www.cochranelibrary.com/about/central-landing-page.html
(2)Pubmed数据库:https://www.ncbi.nlm.nih.gov/pmc/
(3)Embase数据库:https://www.elsevier.com/solutions/embase-biomedical-research
(4)SinoMed数据库(含CBM数据库):http://www.sinomed.ac.cn/
(5)CNKI全文数据库:http://www.cnki.net/
(6)维普全文数据库:http://lib.cqvip.com/
(7)万方数据库:http://new.wanfangdata.com.cn/index.html
(8)临床试验数据库:如中国临床试验注册中心(http://www.chictr.org/cn/),美国临床试验注册平台(https://clinicaltrials.gov/)等。
除以上数据库外,需要结合评价的药品和疾病,检索相应的专业数据库,如中医药需要检索相应的专业文献数据库。必要情况下还需要联系持有人和已知研究团队获取灰色文献,检索已经发表文献的参考文献,通过临床研究注册库获取相关研究信息。
2.其他相关网址举例:
(1)WHO 国际临床试验注册平台(ICTRP):http://www.who.int/ictrp/en/
(2)WHO 基本药物目录(EML):http://www.who.int/medicines/publications/essentialmedicines/en/
(3)国家食品药品监督管理局:http://www. nmpa.gov.cn/
(4)国家药品不良反应监测中心:http://www.cdr-adr.org.cn/
(5)美国食品药品监督管理局:https://www.fda.gov/default.htm
(6)欧洲药品局:http://www.ema.europa.eu/ema/
(二)纳入文献资料提取表(供参考)
表1 RCT研究文献特征摘录表
| 纳入研究 | 研究地区 | 人群 | 例数I/C | 年龄 | 性别(M/F) | 病程(年) | 疾病类型 | 疾病分期 | 干预措施 | 对照措施 | 疗程 | 结局指标 | 资助类型 | |||
| I | C | I | C | I | C | |||||||||||
| 研究1 | ||||||||||||||||
| 研究2 | ||||||||||||||||
| …… | ||||||||||||||||
| 研究n | ||||||||||||||||
注:1. I:试验组;C:对照组; M:男性;F:女性
2.每一个文献评价的纳入文献特征表都可以在共性条目基础上增加个性化条目,下同。
3.资助类型指资助来源,比如国家或者省级科技计划、自然基金等公共经费以及持有人资助等。
表2 临床试验/队列研究不良反应/事件发生情况信息摘录表
| 编号 | 作者+年份 | 研究地区 | 人群 | 事件数/样本量 (n/N) | 年龄 | 研究组剂量 | 对照组剂量 | 合并 用药 |
观察 时间 |
病程 | |
| 研究组 | 对照组 | ||||||||||
| 研究1 | |||||||||||
| 研究2 | |||||||||||
| …… | |||||||||||
| 研究n | |||||||||||
表3 病例系列/横断面研究不良反应/事件发生情况信息摘录表
| 编号 | 作者+年份 | 研究地区 | 人群 | 样本量 | 年龄 | 剂量 | 合并用药 | 观察时间 | 不良事件发生数 | 不良事件预后 |
| 研究1 | ||||||||||
| 研究2 | ||||||||||
| …… | ||||||||||
| 研究n |
表4 不良反应/事件个案报道基本情况表
| 编号 | 作者+年份 | 研究地区 | 基础 疾病 |
剂量 | 年龄 | 过敏史 | 既往史 | 自服药起到出现不良事件的时间 | 不良事件表现 | 处理 | 转归 | 作者推论 |
| 研究1 | ||||||||||||
| 研究2 | ||||||||||||
| …… | ||||||||||||
| 研究n |
(三)文献质量评价标准
1.随机对照试验质量评价标准
表5 纳入文献质量评价表(以RCT质量评价举例)
| 研究 | 随机序列生成 | 分配方案隐藏 | 盲法 (每个结局单独评价) |
随访完整性(数据缺失) | 选择性报告结局 | 基线可比性 | 试验提前终止 |
| 研究1 | |||||||
| 研究2 | |||||||
| …… | |||||||
| 研究n |
来源:参考Cochrane协作网Risk of Bias偏倚风险评价工具。
(1)随机序列生成:是否详细描述用于生成分配序列的方法,如参考随机数字表、使用计算机随机数字生成器、扔硬币、洗牌的卡片和信封、掷骰子、抽签等,以评估产生的分组是否具有可比性。
(2)分配方案隐藏:是否详细描述隐藏分配序列的方法,以决定干预的分配在纳入之前或纳入过程中是否可见。
(3)盲法:是否描述对参与者和实施者行盲法、避免其了解干预信息的所有措施,提供任何与所实施的盲法是否有效的相关信息。是否描述对结局信息采集者和评价者、统计分析者行盲法、避免其了解自己所接受的干预信息的所有措施,提供任何与所实施的盲法是否有效的相关信息。
(4)随访完整性:是否详细记录并报告各组病人失访/退出数据及具体原因。
(5)选择性报告结局:是否按照方案中的结局设置(包括测量方法、时点和统计方法)报告结果信息,并且报告了所有临床上认为应该有的重要结局;如果方案不可及,判断研究是否报告了所有应该有的重要结局。
(6)基线可比性:A 可比;B 不清楚;C 不可比。
(7)试验是否提前终止:是否提前终止及其提前终止标准和原因。
(8)观察的治疗期间是否恰当,或治疗周期是否合理。
2.非随机分组的对照研究
非随机分组的对照试验方法学评价指标采用MINORS清单(Methodological Index for Non-Randomized Studies,MINORS)。
(1)研究目标
(2)连续患者的入组
(3)前瞻性的数据收集
(4)合适的研究终点指标
(5)终点指标的无偏倚评价
(6)主要终点指标的随访时间
(7)失访不超过5%
在比较研究中增加:
(8)对照组是否是干预的金标准
(9)是否平行组
(10)基线是否相当
(11)样本量计算是否合理
(12)统计分析是否与研究设计相适应
(来源:Slim K,Nini E,Forestier D,Kwiatkowski F,Panis Y,Chipponi J. Aust NZ J Surg. 2003;73:712–716)
3.队列研究与病例对照研究
队列研究与病例对照研究应采用Newcastle-Ottawa Scale (NOS)文献质量评价量表(中文版)评价研究文献。
(1)病例对照研究
注意:选择与暴露类每项最多给一星(*);比较类每项最多给两星(**)。
选择
1)病例定义是否准确?
a)是,有单独的确认 *;b)是,例如记录链接或者基于自报告;c)未描述
2)病例代表性
a)连续性的或者具有显著代表性的病例系列*;b)有潜在的选择偏倚或者未描述
3)对照的选择
a)社区对照 *;b)医院对照;c)未描述
4)对照的定义
a)无疾病(终点)史* ;b)未描述
比较
1)基于研究设计或者分析,病例与对照的可比性
a)对照目的:(选择最重要的因素)*
b)对照目的是其他因素(该标准可能会修订成“指出具体对照的次重要因素”)*
暴露
1)暴露的确认
a)可靠的记录(如手术记录)*;b)当病例与对照处于盲态时开展结构化的访谈* ;c)当病例与对照不处于盲态时开展访谈;d)仅有书面的自报告或者医疗记录;e)未描述
2)对病例与对照的确认是否采用相同的方法
a)是 * ;b)否
3)无应答率
a)两组有相同的应答率 * ;b)未描述;c)两组应答率不同并且未定义应答率
(2)队列研究
注意:选择与暴露类每项最多给一星;比较类每项最多给两星。
选择
1)暴露队列的代表性
a)描述了社区里真正具有代表性的暴露平均水平*
b)描述了社区里有一定程度代表性的暴露平均水平*
c)用户组(如护士、志愿者)的选择;d)未描述队列的来源
2)非暴露队列的选择
a)与暴露队列在同一社区选择* ;b)从不同来源选择;c) 未描述非暴露队列的来源
3)暴露的确认
a)有把握的记录(如手术记录) *;b)结构化的访谈* ;c)书面的自报告;d)未描述
4)在研究启动时,并未提出所关注结局事件
a)是 * ;b)否
可比性
1)基于研究设计或者分析,队列的可比性
a)对照目的:(选择最重要的因素)*
b)对照目的是其他因素(该标准可能会修订成“指出具体对照的次重要因素”)*
结局
1)结局的评估
a)盲态独立评估* ;b)记录链接 * ;c)自报告;d)未描述
2)为发现结局事件,随访时间是否足够长
a)是(对于所关注的结局事件,选择了充分的随访时间) * ;b)否
3)队列的随访是否充分
a)全部随访 * ;b)少量失访不会带来偏倚,超过____ % 的随访,或者描述了失访者的情况* ;c)低于____ % 的随访,并且未描述失访者的情况;d)未描述
(来源:Wells G, Shea B, O’Connell D, et al. http://www.ohri.ca/programs/clinical_epidemiology/nosgen.pdf)
4.病例系列研究的评价
英国国立临床优化研究所(National institute for clinical excellence,NICE)对病例系列的质量评价做如下推荐:
(1)为了提高研究结果的代表性,病例系列中的病例最好来自不同级别的医疗机构,开展多中心的研究院;
(2)清楚明确的描述研究的假说或目的、目标;
(3)清楚的报告纳入和排除标准;
(4)对测量的结局做出明确的定义;
(5)收集的数据应达到预期目标;
(6)准确描述患者是连续招募的;
(7)清楚明确描述研究主要发现;
(8)将结局进行分层分析及报告,如按照疾病分期、化验结果异常、患者的特征等。
(四)证据分级标准
表6 GRADE证据4个等级的含义
| 质量级别 | 当前定义 |
| 高 | 非常确信真实的效应值接近效应估计值 |
| 中 | 对效应估计值有中等程度的信心:真实的效应值有可能接近估计值,但仍存在二者大不相同的可能性 |
| 低 | 对效应估计值的确信程度有限:真实值可能与估计值大不相同 |
| 极低 | 对效应估计值的确信程度很低:真实值很可能与估计值大不相同 |
来源: GRADE guidelines: 3. Rating the quality of evidence(April 2011)
表7 GRADE证据质量分级法总结
| 研究设计 | 证据质量 | 如存在以下情况则证据降级 | 如存在以下情况则证据升级 |
| 随机化试验 | 高 ++++ |
•偏倚风险 –1 严重 –2 非常严重 •不一致性 –1 严重 –2 非常严重 • 间接性 –1 严重 –2 非常严重 • 不精确性 –1 严重 –2 非常严重 • 发表偏倚 –1 可能 –2 非常可能 |
• 效应量大 +1 大 +2 非常大 • 剂量反应 +1 梯度证据 • 所有可能的混杂因素 +1 降低所展示的效应 +1 如果研究结果显示无效,提示这是一种假效应 |
| 中 +++ |
|||
| 观察性研究 | 低 ++ |
||
| 极低 + |
来源: GRADE guidelines: 3. Rating the quality of evidence(April 2011)
文献评价报告撰写可参考系统综述和Meta分析优先报告的条目(PRISMA声明)、流行病学中观察性研究的Meta分析。
(五)PRISMA声明和MOOSE声明
表8 PRISMA声明
| 内容/条目 | 编号* | 标准PRISMA条目要求 |
| 标题 | ||
| 标题 | 1 | 表明研究是系统综述、Meta分析或两者均是 |
| 摘要 | ||
| 结构化摘要 | 2 | 使用结构化的格式,包括:背景、目的、数据来源、研究纳入标准、研究对象、干预措施、评价和合成研究结果的方法、结果、局限性、结论及主要发现的意义、系统综述注册号 |
| 引言 | ||
| 理论基础 | 3 | 介绍当前已知的理论基础 |
| 目的 | 4 | 明确描述临床问题,包括说明研究人群、干预措施、对比组、研究结局及研究设计 |
| 方法 | ||
| 研究方案及注册 | 5 | 表明是否撰写研究方案、如有则是否及在何处可获得该方案(如网络下载地址),如有可能应当提供含注册号的注册信息 |
| 纳入标准 | 6 | 详述作为纳入标准的研究特征(如PICOS, 随访时间等)及报告特征(如发表年、语言、发表状态等),并作合理说明 |
| 信息来源 | 7 | 介绍所有检索的信息来源(如注明收录年份的文献数据库、与作者联系以识别更多研究)及末次检索的日期 |
| 检索 | 8 | 至少报告对一个数据库使用的全部电子检索策略,包括所有使用的限制项,以保证该检索可被重复 |
| 研究选择 | 9 | 描述选择研究的过程,如筛选、纳入标准、是否纳入系统综述、是否纳入Meta分析等 |
| 数据提取 | 10 | 描述从研究报告中提取数据的方法(如使用经过预试验后定制的提取表格、独立提取、重复提取等)及从研究者索取或确认数据的过程 |
| 数据变量 | 11 | 列表定义所有数据提取变量(如PICOS,资助来源等)及对数据变量的任何假设和简化形式 |
| 单项研究偏倚 | 12 | 描述评价单项研究可能存在的偏倚的方法(说明评价是针对研究还是仅针对研究结果),以及在数据合并中如何使用这些偏倚评价结果 |
| 概括效应指标 | 13 | 描述主要效应测量指标,如相对危险比,均值差等 |
| 研究结果合成 | 14 | 描述处理数据及合并结果的方法,如做了Meta分析,还应当说明每项Meta分析的异质性检验方法(如I2等) |
| 合并研究偏倚 | 15 | 说明对可能影响数据合并结果的合并研究偏倚(如发表偏倚,研究内选择性报告结果等)的评估方法 |
| 其他分析 | 16 | 描述其他分析方法,如敏感性分析、亚组分析、Meta回归等,并说明哪些是事先计划的分析 |
| 结果 | ||
| 研究选择 | 17 | 提供筛选研究数、进行纳入评价的研究数、最终纳入研究数,并说明各阶段排除理由,最好绘制流程图 |
| 研究特征 | 18 | 描述每个被提取数据资料的研究的特征(例如样本量、PICOS、随访时间等),并标出引文出处 |
| 单项研究内部偏倚 | 19 | 展示各单项研究可能存在偏倚的相关数据,如有可能,列出偏倚对结局影响的评价结果,参见条目12 |
| 各单项研究结果 | 20 | 对所有结局指标(获益或危害),均报告:(a)每个干预组的摘要数据; (b)效应估计值及其CI,最好用森林图展示 |
| 研究结果合成 | 21 | 展示每项Meta分析的结果,包括CI及异质性检验结果 |
| 合并研究偏倚 | 22 | 展示对合并研究偏倚的评估结果,参见条目15 |
| 其他分析 | 23 | 如进行了其他分析,则描述其结果,如敏感性分析、亚组分析、Meta回归等,参见条目16 |
| 讨论 | ||
| 总结证据 | 24 | 总结主要发现,包括在每项主要结局指标上证据的有力程度,考虑这些发现对主要利益相关者(如卫生服务提供者,使用者及政策制订者)的参考价值 |
| 局限性 | 25 | 讨论单项研究及其结局层面的局限性(如存在偏倚的可能性)和系统综述研究层面的局限性(如未能获得所有已识别文献具体信息,报告偏倚等) |
| 结论 | 26 | 结合对其他相关证据的描述,提出对研究结果的概要性解读,及其对进一步研究的启示 |
| 资助 | ||
| 资助来源 | 27 | 描述系统综述的资金资助和其他资助(如提供数据)的来源,及资助者在完成系统综述中所起的作用 |
表9 MOOSE声明
| 报告要求 | ||
| 研究背景 定义研究问题 陈述研究问题假设 确定研究结局 暴露/干预措施 研究设计类型 研究人群 文献检索策略 文献检索的资格(如图书管理员和调查员) 文献检索策略,包括文献检索的时间范围和使用的关键词 尽可能获取所有文献,包括研究文献作者的个人通信 检索的数据库和档案库 采用检索软件及其版本号,包括使用的特殊功能(如进行主题词及其下位词的扩展检索) 手工检索(如已有文献的参考文献清单) 列出纳入和排除的文献,以及判断标准 处理非英语文献的方法 处理只有摘要和未发表文献的方法 介绍个人通信的情况 研究方法 描述检索文献是否符合研究问题 数据整理和编码的基本原则(如有完善的临床编码规则或便于编码) 数据分类和编码的记录(如多个文献评价者,盲法,以及文献评价者之间的一致性) 混杂的评估(如入选研究中病例和对照的可比性) 评价研究质量,包括对质量评价者采用盲法,对研究结果的可能预测值进行分层分析或者回归分析 评价研究异质性 详细介绍统计分析模型,以便能重复该研究(如详细描述采用的固定效应模型或者随机效应模型,采用该研究模型分析研究结果的理由,剂量反应关系模型,或者累积Meta分析) 提供合适的统计图表 研究结果 绘图总结入选各研究和汇总研究结果 列表描述入选各研究结果 研究结果的敏感度分析(如亚组分析) 研究结果统计学稳健性的指标 讨论 定量地评价偏倚(如发表偏倚) 解释排除标准的合理性(如排除非英语文献) 评价入选研究的质量 研究结论 导致观察到结果的其他可能原因 根据研究所得的数据,在评价文献涉及的领域,对研究结论进行适当地外推 为以后该问题的研究提供指导意见 公布研究资助来源 |
||
(六)报告撰写格式
1.封面
上市后文献评价报告
编号:
评价题目:
评价机构:
主要研究者:
评价时间:
报告时间:
更新时间:
项目来源:
项目发起者:
年 月 日
2.摘要:
题目
背景
目的
资料与方法
结果
结论与建议
3.正文
题目
背景:说明立项依据和意义
目的
研究设计
资料与方法
结果:按评价设计分部分报告结果
安全性评价结果和有效性评价结果
讨论:
总结,回答问题
提出结论证据及强度
指出本评价的局限性
建议今后开展研究或者评价的内容与方向
4.参考文献
5.评价者、评价单位、评价日期
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。