24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

本指导原则旨在指导注册申请人对第二类硬性光学内窥镜(自然孔道类)注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对第二类
查看详情
本指导原则旨在指导注册申请人对第二类腹腔镜手术器械注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对第二类腹腔镜手术器
查看详情
本指导原则旨在指导注册申请人对酶联免疫分析仪注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对酶联免疫分析仪的一般要求
查看详情
本指导原则旨在指导注册申请人对医用电动吸引器注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对医用电动吸引器的一般要求
查看详情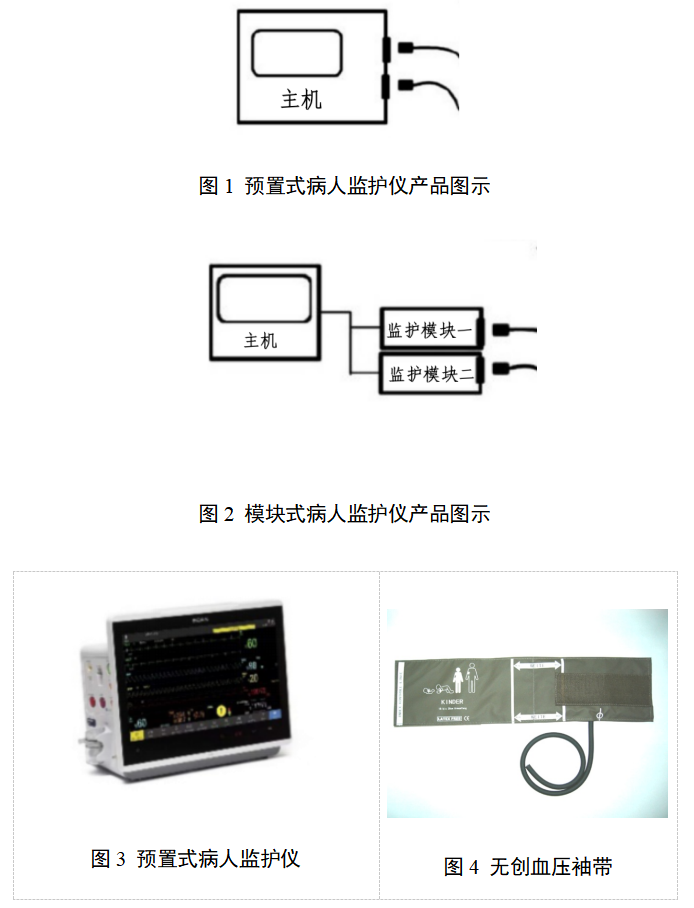
本指导原则旨在指导注册申请人对病人监护产品注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对病人监护产品的一般要求,注册
查看详情
本指导原则旨在指导注册申请人对心电图机产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对心电图机产品的一般要求,申请
查看详情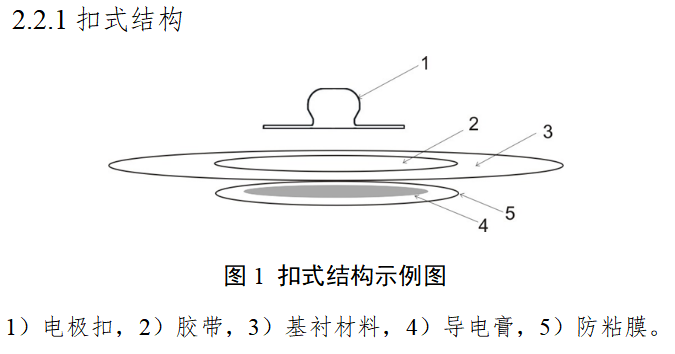
本指导原则旨在指导注册申请人对一次性使用心电电极注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对一次性使用心电电极的
查看详情
本审评要点旨在针对肿瘤基因突变检测试剂(NGS方法)的部分重点问题明确技术审评要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的
查看详情