24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
ISF(研究者文件Investigator Site File)是由研究者负责收集的、关于研究在site层面上所必须的一些文件(原件或复印件)。在临床试验中,完整的必需文件可以验证试验的执行是否遵从了GCP标准及有关管理法规,是评价临床试验质量的重要依据之一。

CRA也或多或少都经历过自己的项目被QC/QA,肯定知晓ISF是必须被查看的(很多时候也是首先被查看的文件)。良好的ISF管理,可以给QC/QA人员留下较好的第一印象。【QC就是在Operation 内部做Quality Control, 通过CO-M,Quality Visit, In-house document review等保证项目是可控的并且质量达到要求。QA单独的一条线,独立于Operation,通过Audit 来保证公司的质量体系可控并符合法规要求。】虽然从ISF定义上看,收集的责任在研究者,作为众多文件、文档的首要经手人和归档人,CRA以及CRC也需要来协助研究者管理ISF。ISF的及时收纳和整理、保证文件完整性都是很重要的。
为了方便动态使用及管理,我们常常会将ISF分类,大致如下图所示。
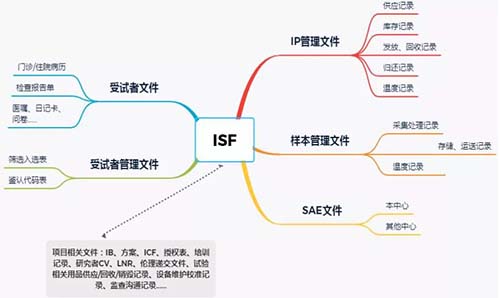
1、建立有效标识:通常我们会在文件夹放置侧标签,列出项目简写名称、方案号、中心号等;
2、建立目录:文档可以建立一个总目录,然后用已编码的隔页分开。如果某个目录下的文件较多,可以建立子目录,进行动态更新,比如伦理递交信、方案偏离报告等;
3、建立临时文件夹:我的习惯是会建立一个临时的文件夹,告知CRC那些待签字、待修改、待归档文件可以按递交或签字时间顺序放在临时文件夹;
4、及时归档:放在临时文件夹的文档在监查时进行核对、扫描或者复印,然后及时进行归档ISF相应处。需要留意的是文档SOP更新(来自申办方/CRO/Site)时记得及时更新SOP,这也是项目文档被稽查时容易查出问题的地方。
5、专人专柜保管:没有记录就没有发生,文档保管的重要自是不言而喻。项目文件需要是授权的专人进行保管,且需要专柜保管,不能与其他项目资料混合存放。
虽然此篇的主题是ISF管理,但谈到ISF必然会对应到TMF(Trial Master File)。药物临床试验的TMF管理也是依据GCP法规,并结合申办方或CRO的SOP,对药物临床试验所产生的资料进行的一系列规范化操作管理,同样反映试验的质量。
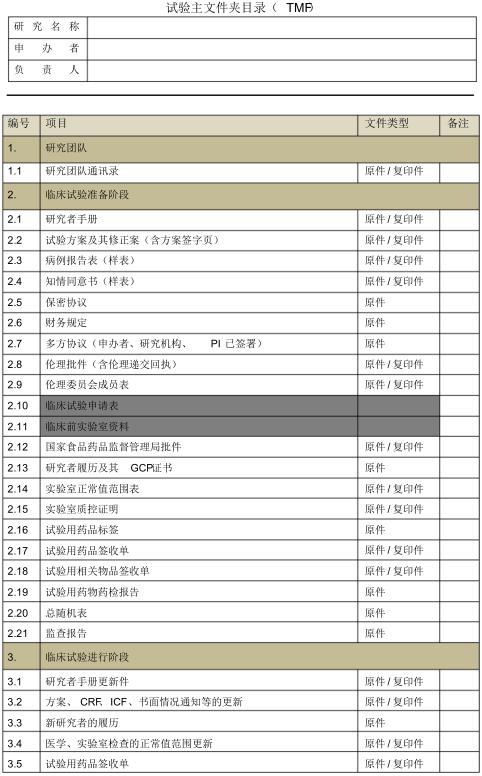
TMF目录1
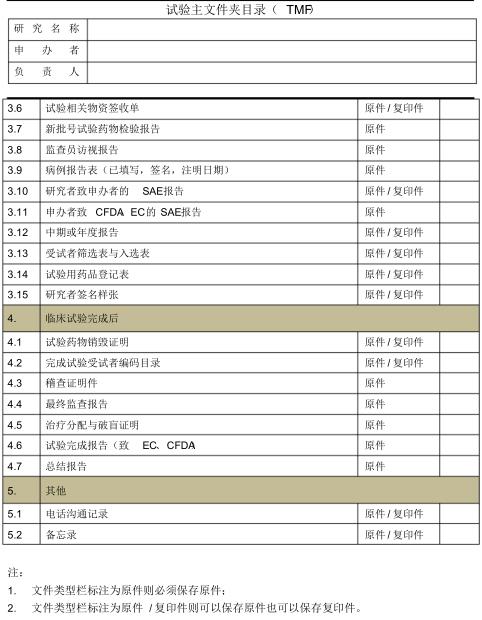
TMF目录2
TMF是由PM根据项目将要求列出,然后与CTA对接,将项目文档需求明确至CTAs并签字确认,建立TMF,同时也让项目组成员知晓。在试验开展期间PM还需要监督TMF的质量和保存。TMF收集由CTA进行,并需要对CRA提供的文档进行核对、追踪、存档。定期汇报TMF进展,对滞后的文档收集做督促和提醒。
CRA需要将收集的TMF及时传送给CTA,这一环节也很能体现CRA工作的计划性。收集TMF前需先制定计划,重视监查前的准备,在监查时进行收集。收集前、收集时、归档均需检查文件质量是否符合要求。经常有A会问到试验结束时ISF的归档。通常CRA需要将ISF与TMF进行一致性核对,避免文档不一致及查缺补漏,然后与研究者进行文档的交接。
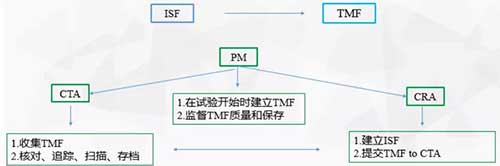
至于归档,首先是看试验开展所在中心的机构要求,如果可以接受CRO或申办方的ISF目录,那自然最方便。如果机构要求使用自己文件归档的目录进行ISF整理归档,那就需要根据机构提供的目录进行重新整理。
最后提供一个小技巧,当有其他方来QC&QA你的项目时,记得将提醒QC&QA人员签署Site Visit Log作为第一事项,这样可以显示出A的良好GCP意识,有助于建立较好的第一印象。
来源:药物临床试验网-小乙
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。