24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

窝沟封闭剂产品注册审查指导原则
本指导原则旨在帮助和指导申请人对窝沟封闭剂产品注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对该类产品进行
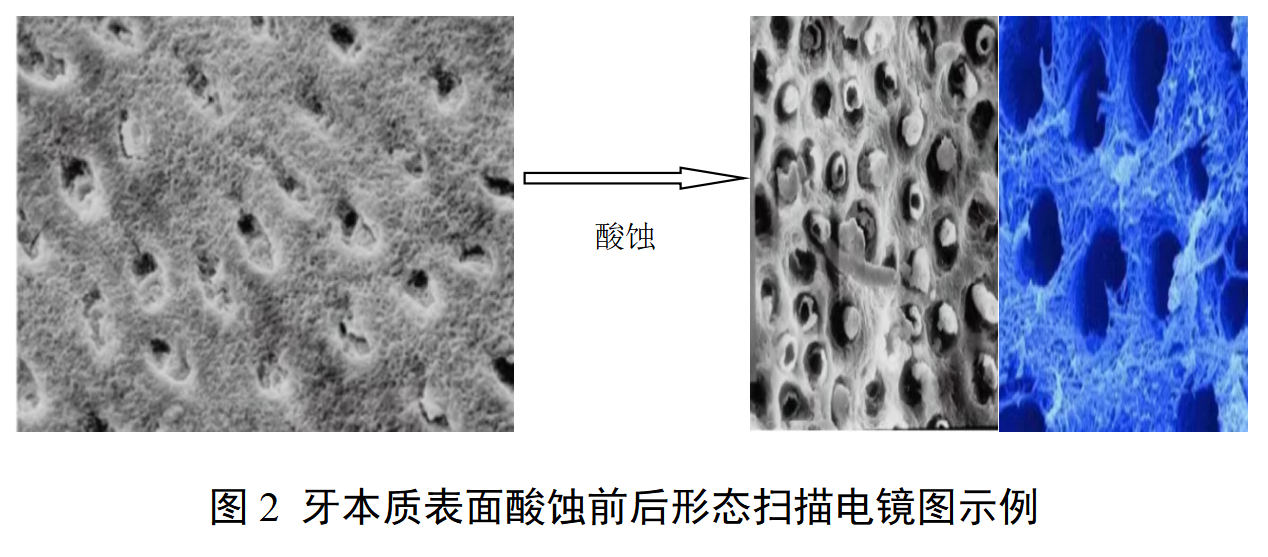
牙科用磷酸酸蚀剂注册审查指导原则 本指导原则旨在指导注册申请人对牙科用磷酸酸蚀剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指
查看详情
日益提升的临床应用需求,日益提升的科学水平及产业水平,及法规天然具有的滞后性,越来越多的出现医疗器械注册人拟申报的医疗器械产品在已发布的《医疗器械分类目录》中查询不到对应细项分类,这时,企业通常需要通过医疗器械分类界定路径来界定产品管理类别。本文来说说申请医疗器械分类界定?准备工作事项。
查看详情
连日来,江苏省药监系统紧跟当前形势,聚焦疫情防控关键环节和重点领域,主动跨前一步、积极担当作为,全力协调防疫药械保供事项,加强质量安全监管,着力维护市场稳定和人民群众生命健康安全。江苏省药监局紧跟疫情形势,聚焦新冠抗原检测试剂保供扩产,全力助力新冠抗原检测试剂上市。
查看详情
引用“削足适履”这个典故,更多的是为了引导大家正确看待医疗器械产品使用强制性标准清单适用问题,及从标准适用分类来看,医疗器械行业标准也分成了强制性标准和推荐性标准。
查看详情
不只是定制式固定义齿注册产品,对所有定制式医疗器械注册产品来说,选择典型型号一直都是难点,如何选择有代表性的典型型号,且能被药监局审评老师认可,一起看正文。
查看详情
有创压力传感器产品注册审查指导原则
本指导原则旨在指导申请人对有创压力传感器产品(简称“产品”)注册申报资料的准备及撰写,同时也为技术审评部门审评注册

经鼻胆汁外引流管注册审查指导原则
本指导原则旨在指导和规范经鼻胆汁外引流管产品的注册申报工作,帮助申请人理解和掌握该类产品的原理/机理、结构、主要风险、性能、预