24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

医疗器械延续注册的时间节点与多数证书续证规定有明显区别,为了更大可能的为证书的持续有效提供保障,医疗器械续证要求企业必须在到期6个月前提交第二类医疗器械延续注册申报资料,真实情况,错过延续注册导致证书失效的情形时有发生。本文来写个亡羊补牢式的要点,错过医疗器械延续注册时间,临床评价怎么办?
查看详情
8月26日,国家药监局发布创新医疗器械特别审查申请审查结果公示(2022年第6号),人乳头瘤病毒基因整合(14个型)核酸检测试剂盒(可逆末端终止测序法)等10项创新医疗器械特别审查申请获批,其中江浙沪地区5项高风险创新医疗器械特别审查申请获批。
查看详情
近年来,在国家政策支持鼓励、产业生态持续向好等利好因素下,我国医疗器械产业发展迅速。北京市药监局紧紧围绕“两区”(国家服务业扩大开放综合示范区、北京自
查看详情
对于第一类医疗器械备案来说,近期法规调整较大,比如增加了检验报告的照片要求等,强化了备案资料真实性要求,及承诺制对企业的诚信行为监管要求。本文跟大家聊聊新《医疗器械生产监督管理办法》自2022年5月1日起施行后,第一类医疗器械若增加生产产品品种,应如何办理?
查看详情
依照法定程序,进行申请注册。 一类医疗器械注册申请材料: (一)境内医疗器械注册申请表; (二)医疗器械生产企业资格证明:营业执照副本; (三)适用的产品标准及说
查看详情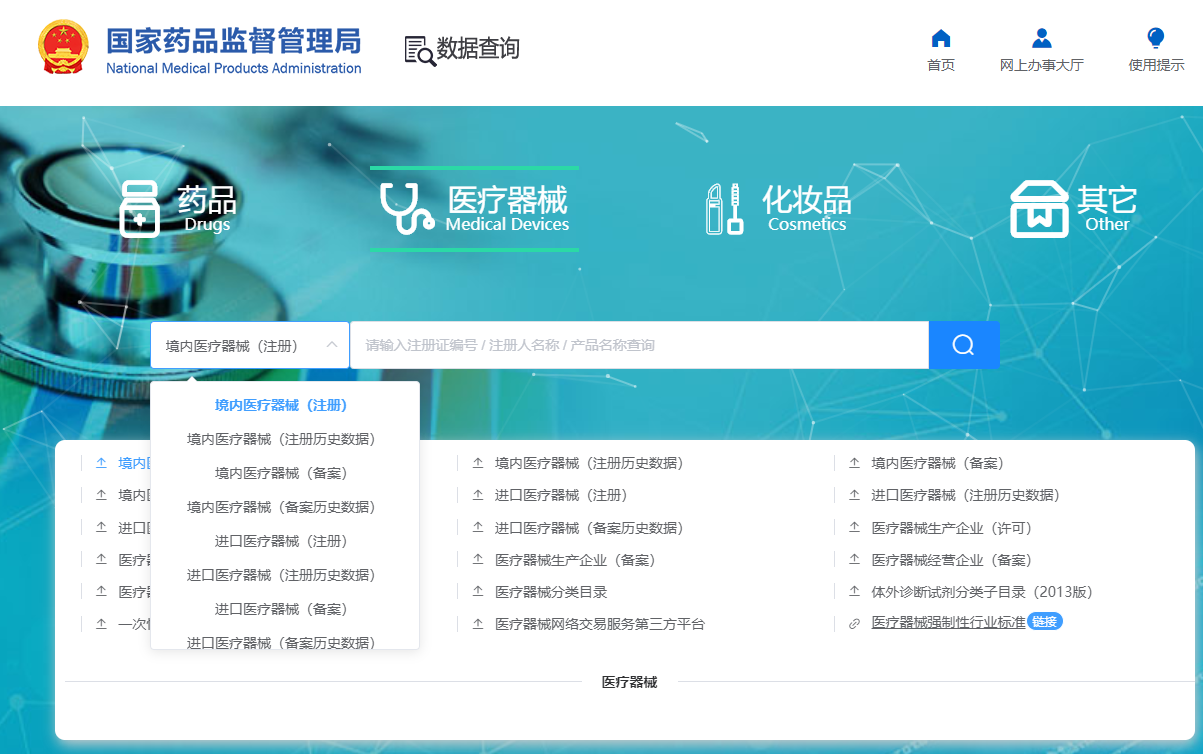
想知道您购买的医疗器械产品是否合法,就要查询产品是否拥有医疗器械注册证,那么医疗器械产品注册证怎么查询?接下来,和小编一起来看看吧!具体流程如下: 1、首先,我们打开
查看详情
体外诊断试剂和器械在国外统一称为体外诊断医疗器械。 属于医疗器械的一部分。在我国,体外诊断试剂是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、
查看详情
作为高值耗材大类,冠脉支架最先遭到“灵魂砍价”,球囊、导管导丝等辅助耗材价格也全线下调,行业格局被重塑。头部企业转舵,加大心脏瓣膜、电生理、外周介入、神经
查看详情