24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

临床试验启动会召开前后,大致有7个会议,每个会议的议程各不相同,比如方案讨论会,探讨的是方案的可实行性和具体病例数等等因素的确定,启动会后也还有3个会议才能正式宣布临床试验阶段结束。先看看临床试验会议分类:
查看详情
正所谓,无规矩不成方圆。对于一个周期长,涉及面广的临床试验,做好计划是项目经理的必要工作。完整的项目管理需要由针对该项目情况的监查手册,监查手册有些公司也称为监查计划。
查看详情
作为一个Clinical Operations的项目管理者,经常会去Site做Co-Visit。在Site,感觉我们现在项目中“最重要的”角色就是小C-CRC啦。说最重要其实我个人觉得一点不夸张哈,虽然没有研究者的专业职责,也没有PM的高大上,还要给CRA监查,又往往是最年轻的那个,可是在今天中国的临床研究Site,其实Site日常的管理者就是小C啦!哪个项目,哪个Site,每天都离不开小C。
查看详情
环氧乙烷灭菌是一种广谱、高效、穿透力强、对消毒物品损害轻微的灭菌方法。环氧乙烷分子式C2H4O,分子量44.05。它的蒸气压比较大,可以穿透微孔而达到物品的深部。其液体和气体均有较强的杀微生物作用,气体的杀微生物作用更强。环氧乙烷可以杀灭各种微生物,包括细菌繁殖体、芽孢、真菌、病毒等,是一种广谱消毒剂。
查看详情
在临床试验行业中,普大众的CRA和CRC常年坚持在一线,(不是我说,要不是生活所迫,谁愿意常年在一线表演,)其责任重大,甚至一个项目的好坏,直接影响了药物的发展。2021年了,涨点工资吧。
查看详情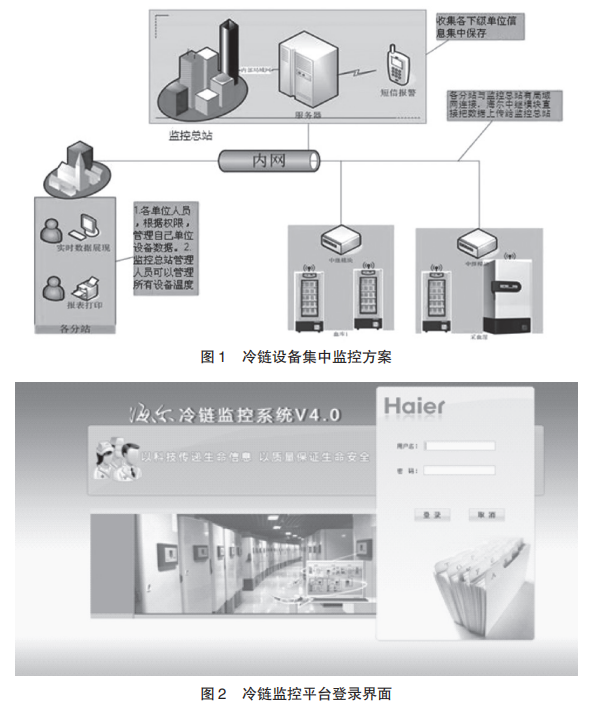
由于体外诊断试剂贮存条件的特殊性,目前,医疗机构体外诊断试剂管理基本是零库存管理模式。试剂验收合格后存储在各科室仓库,体外诊断试剂的使用科室主要有检验科、输血科、核医
查看详情
2016 年起,医疗机构对有冷链要求的体外诊断试剂实施了入库验收制度,要求供应商按照医院规定的时间将产品送到科室,必须由试剂管理部门验收人员、科室人员双方一起验收,验收要求
查看详情
近年来,FDA为促进患者获得创新, 安全的新疗法和诊断方法,制定并实施了突破性器械计划(Breakthrough Devices Program),旨在加快治疗或诊断危及生命或不可逆转疾病的医疗器械的开发和审查。但是FDA认为不符合突破性器械计划但在治疗和/或诊断不太严重的疾病或状况方面具有显著安全优势的医疗器械方面的进步也可以提供重要的公共卫生利益。因此,FDA正在建立医疗器械安全技术计划(STeP)以帮助不符合突破性器械计划资格的医疗器械的安全性创新。
查看详情