24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
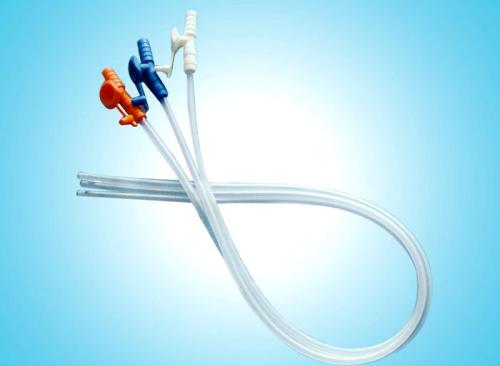
一次性使用吸痰管注册技术审查指导原则(2018年第120号)本指导原则旨在为申请人进行一次性使用吸痰管注册申报提供技术指导,同时也为药品监督管理部门对注册申报资料的审评提供技术参考。本指导原则是对一次性使用吸痰管注册申报资料的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
查看详情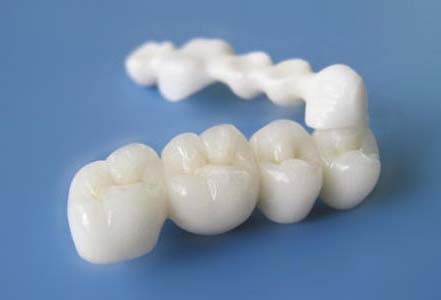
全瓷义齿用氧化锆瓷块注册技术审查指导原则(2018年修订)(2018年第116号)本指导原则旨在为申请人进行全瓷义齿用氧化锆瓷块注册申报提供技术指导,同时也为药品监督管理部门对注册申报资料的审评提供技术参考。本指导原则是对全瓷义齿用氧化锆瓷块的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化。并依据具体产品的特性确定其中的内容是否适用,若不适用,需详细阐述理由及相应的科学依据。本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规和标准的前提下使用本指导原则。
查看详情
吻(缝)合器注册技术审查指导原则(2018年修订)(2018年第120号)本指导原则旨在为申请人进行吻(缝)合器(以下简称吻合器)注册申报提供技术指导,同时也为药品监督管理部门对注册申报资料的审评提供技术参考。本指导原则是对吻合器注册申报资料的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
查看详情
小型分子筛制氧机注册技术审查指导原则(2017年修订版)(2017年第180号)本指导原则旨在指导注册申请人对小型分子筛制氧机的产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对小型分子筛制氧机的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情
超声洁牙设备注册技术审查指导原则(2017年修订版)(2017年第177号)本指导原则旨在指导注册申请人对超声洁牙设备注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对超声洁牙设备产品的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情
助听器注册技术审查指导原则(2016年修订版)(2016年第22号)本指导原则旨在指导注册申请人对助听器注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对助听器的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情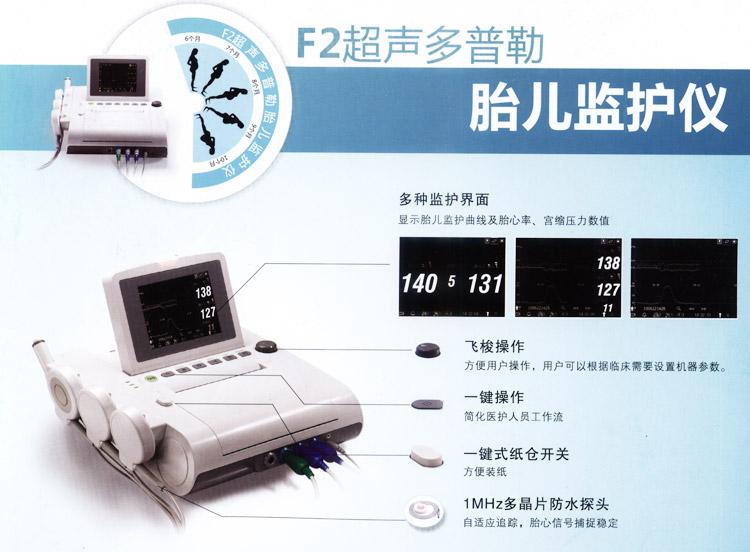
超声多普勒胎儿监护仪注册技术审查指导原则(2017年修订版)(2017年第177号)本指导原则旨在指导注册申请人对超声多普勒胎儿监护仪产品注册申报资料的准备和撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则系对超声多普勒胎儿监护仪注册技术审查的通用要求,申请人应依据具体产品的特性对注册申报材料的内容进行充实细化。申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述其理由及相应的科学依据。
查看详情
医用雾化器注册技术审查指导原则(2016年修订版)(2016年第22号)本指导原则旨在指导注册申请人对医用雾化器注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对医用雾化器的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情