24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
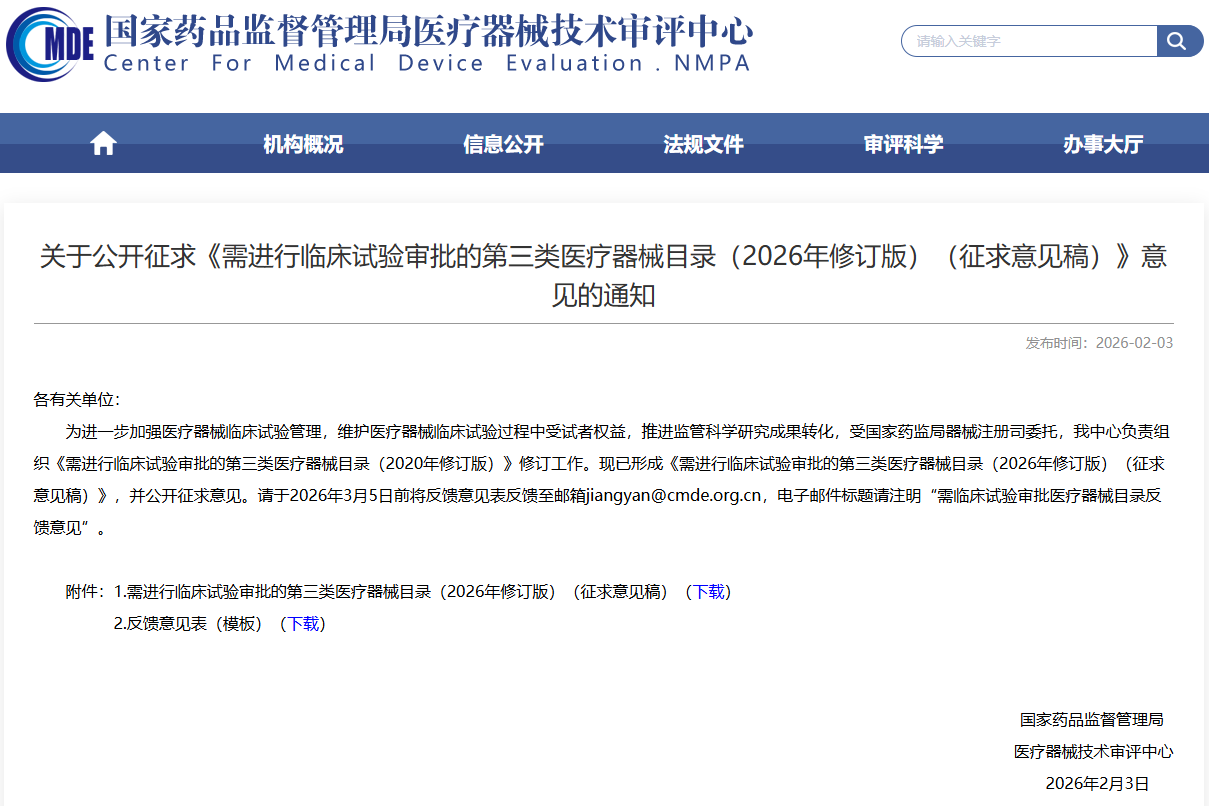
与境内外已上市产品相比,采用全新设计、材料或机理,和/或适用于全新适用范围,且对人体具有较高风险的医疗器械,应当经临床试验审批后方可在中国开展临床试验。 上述原则
查看详情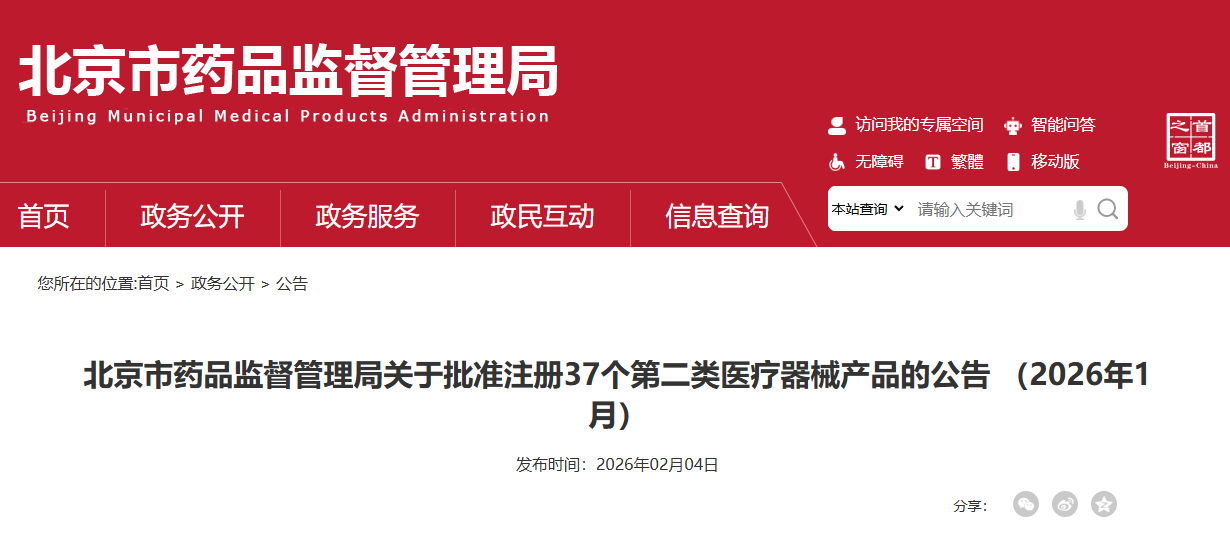
2026年1月,北京市药品监督管理局共批准注册第二类医疗器械产品37个(具体产品见附件)。 特此公告。 附件:2026年1月批准注册第二类医疗器械产品目录 北京市药品监督管理
查看详情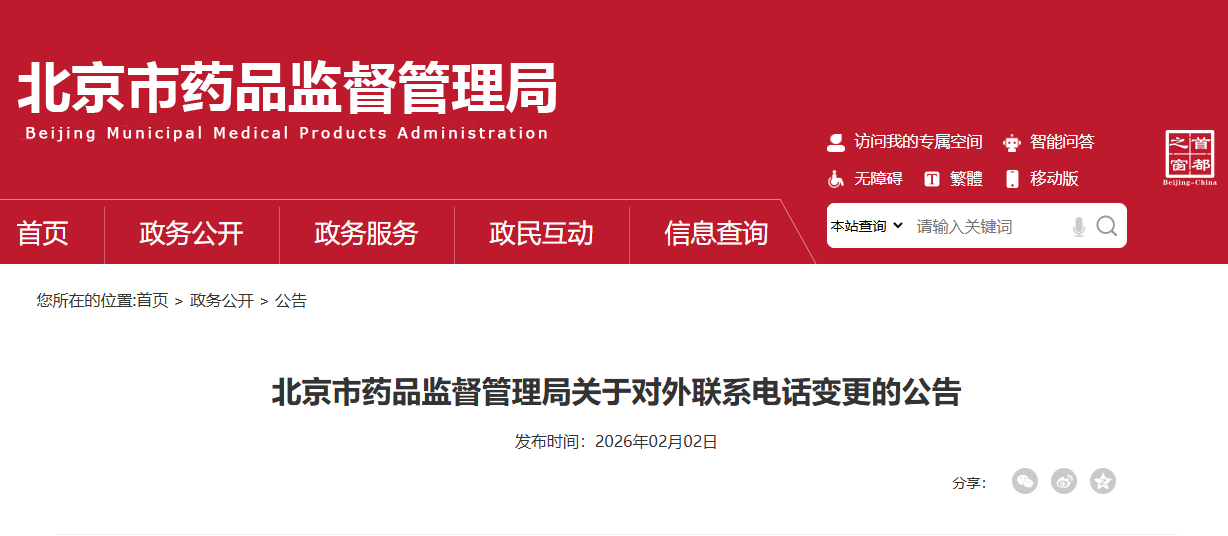
为进一步规范政务服务渠道,提升沟通响应效能,方便公众咨询办事,根据工作安排,我局对外联系电话将进行变更,现将具体事宜公告如下: 一、变更内容 对外综合联系电话、政府
查看详情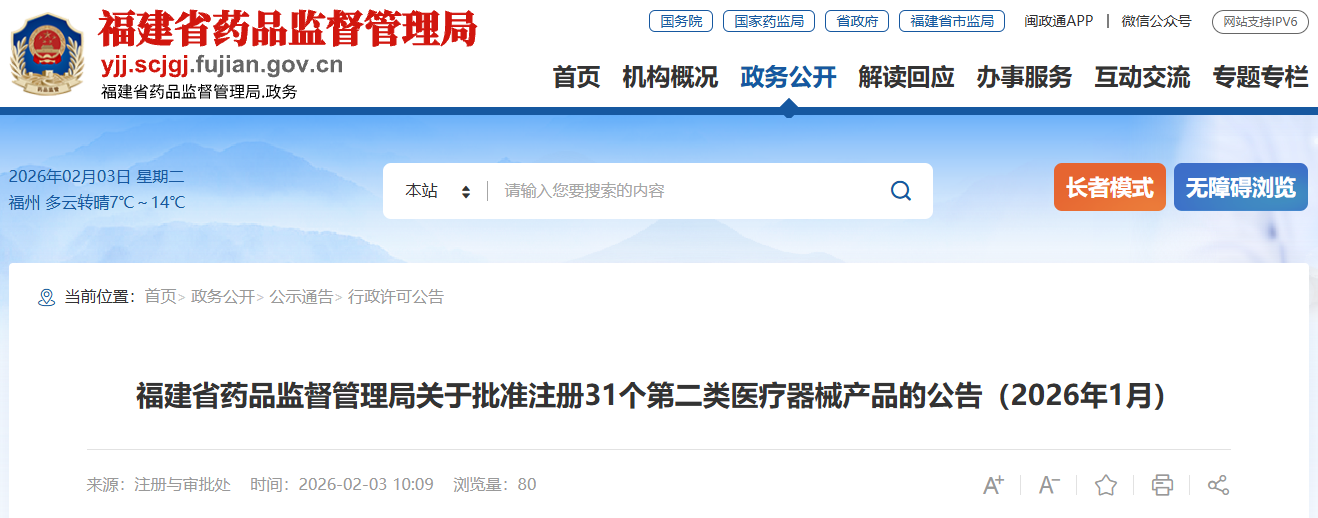
2026年1月,福建省药品监督管理局共批准注册第二类医疗器械产品31个。 特此公告。 序号 注册人名称 产品名称 注册证编号
查看详情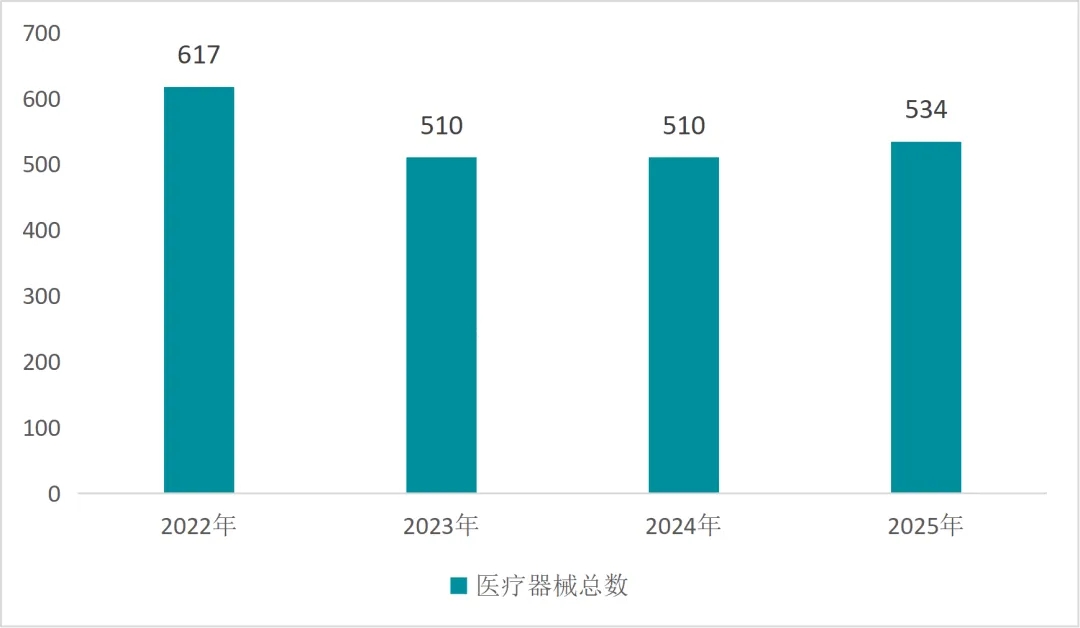
在2025年这个对于中国医疗器械行业而言值得关注的年份里,全年中国医疗器械所获得的FDA认证总量达到534件,该数据相比上一年度呈现出4.7%的微增态势,进而展现出一种温和修复
查看详情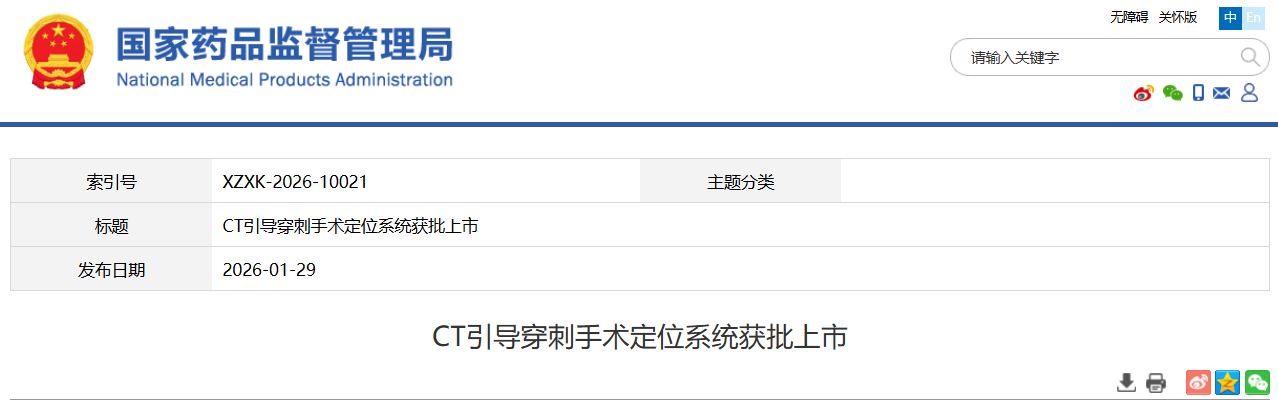
最近由国家药品监督管理局公布的一项正式批准三款创新医疗器械产品上市注册申请的重要消息中,涉及来自国内多家医疗科技企业的产品,慧扬医疗科技(苏州)有限公司的射频穿刺
查看详情
关于医疗器械技术审评中心第六批外聘专家候选人的公示 为保障医疗器械技术审评工作科学公正,充分发挥外聘专家在医疗器械技术审评中的作用,根据《医疗器械技术审评中心
查看详情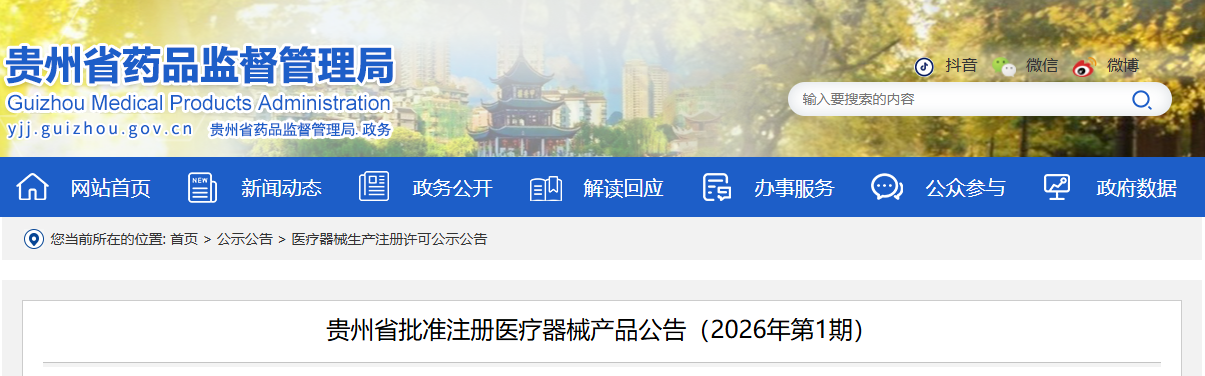
根据《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》等相关规定,现将2025年12月贵州省药品监督管理局批准境内第二类医疗器械及体外诊断试剂有关情况
查看详情