24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

本指导原则旨在为监管部门对可穿戴体外自动除颤设备注册申报资料的技术审评提供技术指导,同时也为注册申请人进行该类产品的注册申报提供参考。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法也可以采用,但是需要提供详细的研究资料和验证资料,考虑到该产品临床风险安全有效性确认的需要,验证确认资料需包括申报产品临床试验资料。应在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则所涉及的可穿戴体外自动除颤设备产品(Wearable Cardioverter Defibrillator, WCD)是一种体外除颤设备,由患者穿戴,能够对有心源性猝死风险的患者进行体外除颤,该设备能自动检测心电图,评估是否存在危及生命的室性心律失常,并对心脏进行电击除颤恢复有效心律。可穿戴式心脏复律除颤器的组成成分一般包括可穿戴部分(如电极、电池组、报警模块、监视部件、服装或皮套等)与不可穿戴部分(如电池充电器、调制解调器、测试仪、电脑等)。分类编码为08-03-01,管理类别为第三类。
此类产品一般用于有心脏骤停风险且不适合或拒绝植入除颤器的成年患者,以期在穿戴期间持续采集和分析患者的心电,识别出患者出现危及生命的室颤或室性心动过速并自动进行体外除颤治疗,将患者的心脏恢复到正常节律。该产品预期用于有心脏骤停风险、不适宜植入或拒绝使用植入式除颤器的成人患者。该系统需通过医生处方向患者提供,常规使用时间预计为2-3个月。
本指导原则不适用于如下情形:非穿戴式体外除颤设备;旨在纠正室颤或室性心动过速以外的心律失常的除颤产品;植入式心律转复除颤器,包括血管内植入(Implantable Cardioverter Defibrillator,ICD)、胸骨下植入(Extravascular Implantable Cardioverter Defibrillator,EV-ICD)和皮下植入(Subcutaneous Implantable Cardioverter Defibrillator,S-ICD);带有预测功能或预判式除颤功能的产品。
二、立题依据
申请人需结合临床应用需求等方面分析并明确产品的立题依据,说明产品在设计上及临床前验证和临床确认方面如何满足临床一线的需要,相关内容需在综述资料或临床评价报告中体现。
三、总体原则
申请人需在充分论证申报产品临床意义的前提下,开展临床试验。可穿戴体外自动除颤设备产品需在充分的非临床验证的基础上(包括可用性、穿戴依从性的验证),设计临床试验,并通过临床试验确认产品对可除颤心律识别的准确性、对室性心律失常转复的安全有效性,同时可对于产品可用性评价提供进一步补充支持。
四、除颤心律识别准确性临床试验
(一)临床试验目的
该类产品需包含可动态检测患者发生危及生命的室颤或室性心动过速的功能,该功能对除颤心律检测的准确性(包括误报警率、漏报警率、灵敏度、特异度等)对于除颤能量释放以及患者临床应用至关重要。本试验目的旨在评估除颤心律检测功能的诊断性能,同时可一并评估在预期使用时间内患者穿戴的依从性(即患者能按照医嘱长时间穿戴),以及观察产品穿戴设计的安全性。
(二)临床试验设计类型
建议以独立第三方专家组(多位资深临床医师组成)评阅心电数据作为临床参考标准,评估软件对于危及生命的室颤或室性心动过速检测结果的诊断准确度是否达到各项主要评价指标预期的目标值。
(三)研究对象
根据试验器械预期使用的目标人群,确定研究的总体人群。综合考虑总体人群的代表性、临床试验的伦理学要求、受试者安全性等因素,制定受试者的选择标准,即入选和排除标准。需入组有心脏骤停风险(可能出现危及生命的室颤或室性心动过速)人群的动态心电监测数据作为研究对象,出于伦理角度考虑,一般可选择已植入ICD/S-CID/EV-ICD的成年患者,并考虑对左心功能的要求(如左室射血分数)。患者状态可能对结果准确性判定存在影响,如老年人的皮肤松弛衰老状态,与较年轻的患者正常皮肤相比,监测结果可能存在系统差异;测量时患者多的静息、运动等状态,也可能导致测量结果存在差异,在选择试验人群时宜尽量兼顾覆盖。因该试验需基于申报产品的心电采集方式,一般需前瞻性的基于定义在明确入选和排除标准的基础上连续入组受试者。
(四)评价指标及随访时间
主要评价指标一般需考虑一定时间内(如30天)可除颤心律识别的误报警率和漏报警率。可除颤心律以及误报警的定义需参考临床指南专家共识等进行明确。例如误报警的定义可考虑:
1.心律类型被标记为非室速/室颤;
2.心律类型不确定(推测为非可除颤性);
3.标记为室速/室颤,但心率<153次/min(170bpm-10%)。
次要评价指标及安全性指标:
1.与除颤心律检测准确性相关的指标,如真阳性检测值,漏报事件分析,预估的不当除颤发生率(如误报警率×错过处置的报警发生率);
2.与穿戴依从性相关的指标,如平均每天穿戴时间、总穿戴天数、穿戴舒适度评分等;
3.与安全性相关的指标,如不良事件(包括皮肤不良反应发生率)情况、严重不良事件发生率、器械故障发生率等。
试验期间患者需连续穿戴充分时长的申报产品(如至少30天,并建议试验期间每周进行调查和提醒),并通过申报产品和ICD/S-CID/EV-ICD产品完整记录穿戴期间的动态心电数据和申报产品的报警情况等信息,申报产品和ICD/S-CID/EV-ICD产品完整的心电数据需提供给专家组进行报警准确性的评阅。
(五)临床参考标准构建
申请人应详述临床参考标准的选择、构建方法及理由。一般以专家组对研究对象(动态心电监测数据)的评阅结果作为临床参考标准。通常相关领域(如心内科电生理方向)的高年资医师可组成评阅专家,专家组综合意见作为临床参考标准,申请人需在临床方案中明确:
1.专家数量;
2.专家经验及专业水平;
3.决策机制(如遵循多数意见、背靠背第三人仲裁等);
4.专家决策时所依据的信息(原则上提供给专家组的需为原始心电数据,无产品报警判定标记,专家决策宜综合申报产品心电数据ICD/S-CID/EV-ICD产品心电数据进行判定);
5.判定所依据的临床准则(如诊疗规范、临床指南、专家共识等)。
(六)样本量估算与统计分析
样本量估算需综合考虑临床试验设计、主要评价指标和统计学要求。申请人需明确计算公式、相应参数及确定理由以及所用的统计软件。
采用单组设计时,目标值及预期值需根据临床指南、专家共识以及临床文献的Meta分析合理确定。主要评价指标采用穿戴30天期间可除颤心律识别的误报警率和漏报警率;其中,误报警目标值设定为0.29 次/每人每天,预期值为0.145次/每人每天。一般情况下α=0.05,β=0.2。考虑一定脱落率,为保证临床试验样本与研究总体的匹配性,以及充分的统计学效能,建议临床试验样本量不低于130例。
样本量计算公式如下:
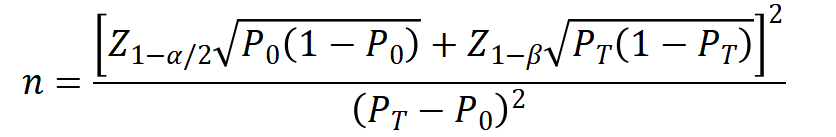
PT为试验组预期事件发生率,P0为目标值。
五、室性心律失常转复临床试验
本试验旨在评估申报产品除颤功能用于室性心律失常转复治疗的安全有效性。评估方法方面,一是可以针对心脏骤停高危患者,评估在一定时间内穿戴申报产品进行室性心律失常转复治疗的安全有效性;二是可以针对需在术中诱导室性心律失常的患者,评估申报产品释放除颤能量进行室性心律失常转复治疗的安全有效性。根据所选择的研究对象的差异可考虑如下两种临床试验设计思路中的一种。
(一)术中诱发室性心律失常的转复治疗试验设计
1.临床试验目的及设计类型
试验目的为验证申报产品用于心搏骤停(Sudden Cardiac Arrest,SCA)高风险人群室性心律失常转复治疗的安全有效性。试验可采用单组目标值设计。
2.研究对象
研究对象一般为计划接受电生理相关手术,且需在术中进行室性心律失常诱发的成年患者,例如:
(1)电生理检查以诱发室性心律失常;
(2)通过已植入的ICD进行非侵入性电生理检查;
(3)计划诱发室性心律失常的ICD更换手术;
(4)室性心动过速消融术(仅进行基质改良而无诱发室性心律失常用途的受试者不纳入本研究)。
3.评价指标及随访时间
对于室性心律失常转复效果的评估一般在术中观察。为了进一步评估申报产品在进行心律转复治疗后更长时间的安全性,建议安全性评价指标的随访时间持续在术后一定时间内,以便较好的评估患者治疗产生的损伤及基本的预后转归情况,例如可选择术后2个月、术后出院前等时间点。
主要评价指标建议考虑累积转复有效率,即使用试验装置成功进行心律转复(第一次或第二次除颤)的受试者人数与试验装置在相应数据集中尝试电击的总诱发次数的比值。
其中,成功的心律转复定义为:通过从试验装置第一次或第二次除颤,将诱发的室性心律(>150次/min)终止为不可除颤复律的心律,注意这里指室速(Ventricular Tachycardia,VT)或室颤(Ventricular Fibrillation,VF)以外的心律。
次要评价指标建议考虑对室速或室颤第一次除颤的转复有效率,安全性评价指标建议考虑收集与试验设备使用可能相关的不良事件。
4.样本量估算与统计分析
样本量估算需综合考虑临床试验设计、主要评价指标和统计学要求。申请人需明确计算公式、相应参数及确定理由以及所用的统计软件。
采用单组设计时,目标值及预期值需根据临床指南、专家共识以及临床文献的Meta分析合理确定。主要评价指标采用累积转复有效率,即使用试验装置成功进行心律转复(第一次或第二次除颤)的受试者人数与试验装置在相应数据集中尝试电击的总诱发次数的比值时,累积转复有效率目标值设定为71.3%,预期值为95%。一般情况下α=0.05,β=0.2。考虑一定脱落率,为保证临床试验样本与研究总体的匹配性,以及充分的统计学效能,建议临床试验样本量不低于20例。
样本量计算公式如下:
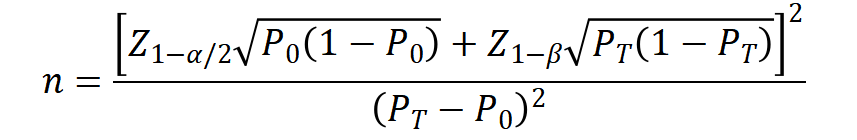
PT为试验组预期事件发生率,P0为目标值。
(二)心脏骤停高危患者室性心律失常转复治疗试验设计
1.临床试验目的及设计类型
试验目的为验证申报产品用于SCA危险的高风险人群中,申报产品室性心律失常转复治疗的安全有效性。试验可采用单组目标值设计。
2.研究对象
具有SCA高风险,既往接受ICD治疗但已移除或不适合植入ICD以及拒绝植入ICD的成人受试者。具体标准可考虑如下方面:
(1)既往植入ICD 但因装置感染或心内膜炎等原因必须移除ICD的患者;
(2)具有ICD 植入指征但因全身性感染、无血管通路等原因需暂缓植入者;
(3)具有ICD 植入指征但因各种原因拒绝植入者;
(4)40天内发生过急性心肌梗死且左室射血分数(Left Ventricular Ejection Fractions,LVEF)≤35%的患者;
(5)3月内接受过冠脉旁路移植术或经皮冠状动脉介入治疗且LVEF≤35%的患者;
(6)等待心脏移植的重度心力衰竭患者;
(7)非缺血性心肌病合并有可能逆转的重度左室收缩功能障碍(如心律失常性心肌病、心肌炎等)、LVEF≤35%的患者;
(8)符合心脏性猝死(Sudden Cardiac Death,SCD)二级预防但预计生存期<1年的患者。
3.评价指标及随访时间
为评估心律转复效果,需保证有足够的可除颤室性心律失常事件,因此一般对接受穿戴式自动体外除颤器治疗的受试者需进行不少于3个月的随访。
主要评价指标可考虑设定为90 天除颤成功率,定义为器械发放适当电击且总体电击成功例次/持续性室速和(或)室颤总例次,其中相关术语定义如下:
(1)持续性室速和(或)室颤定义为,持续时间≥35 秒的室速或室颤发作,该诊断由独立的临床终点事件判定委员会通过阅读受试者病史和穿戴式自动体外除颤器描记的心电原始记录做出,此外,无论是否判定为持续性室速和(或)室颤,由受试者自行终止电击的病例均不计入持续性室速和(或)室颤的总例次;
(2)适当电击定义为,针对明确判定为持续性室速和(或)室颤的病例而发放的电击;
(3)总体电击成功定义为,受试器械发放1次或以上电击后5 秒钟心电图显示心搏停止或非室速或室颤电活动;
(4)受试者发生持续性室速和(或)室颤后心律转复成功或心律未转复成功受试者死亡记为1 例持续性室速和(或)室颤事件,受试器械针对单例持续性室速和(或)室颤事件给予适当电击(电击次数可为1次或多次)并总体电击成功记为1 例器械发放适当电击且总体电击成功事件。
次要评价指标可考虑:
(1)90天全因死亡率;
(2)90天心律失常死亡率,心律失常死亡定义为由室速或室颤导致的死亡,死亡原因由独立第三方进行判定;
(3)适当电击率(例/受试者日),器械发放适当电击总例次/受试器械累积使用时间(日);
(4)首次电击成功率,器械发放单次电击成功转复持续性室速或室颤例次/器械正确识别持续性室速或室颤总例次;
(5)总体电击成功率,器械发放1次或以上电击成功转复持续性室速或室颤例次/器械正确识别持续性室速或室颤总例次;
(6)受试器械每日平均穿戴时间(小时/天);
(7)受试器械平均使用天数(天)。
安全性指标可考虑:
(1)不适当电击率(例/受试者日),受试器械因非VT/VF原因发放电击总例次/受试器械累积使用时间(日);
(2)误报警率(例/受试者日),受试器械因非VT/VF 原因发出警报例次/受试器械累积使用时间(日);
(3)不良事件发生率(例/受试者日);
(4)器械缺陷;
(5)器械故障发生率(例/受试者日)。
六、与临床评价相关的说明书内容
说明书中一般需结合临床与非临床资料给出下列适用的信息:临床试验总结,临床试验总结通常考虑各项临床试验的基本设计、入组人群情况、随访时间、评价指标与结果(必要时含亚组结果),并着重明确不良事件及潜在并发症情况等;适用范围,包括适用人群,适应证,各适应证定义及疾病潜在的风险和需就医复诊的情况等;产品的穿戴方法(包括心电采集电极的位置,除颤电极位置等),如何保证穿戴的牢固性等;对患者的培训要求,包括由开具处方的医院负责的培训,生产企业需开展的培训,以及对患者被培训效果的评估方法等;患者如何确认产品的报警功能及其含义,包括可除颤心律的报警以及除颤失败或检测到患者发生心脏骤停事件发出医疗求救报警等;若产品设计为发出可除颤心律报警后操作者手动触发除颤能量释放,还需明确操作者应在多少时长内触发除颤治疗以及如何触发等。
七、参考文献
[1]国家食品药品监督管理总局.医疗器械临床试验设计指导原则:食品药品监管总局通告2018年第6号[Z].
[2]国家药品监督管理局.医疗器械临床评价技术指导原则:国家药品监督管理局通告2021年第73号[Z].
[3]American College of Cardiology/ American Heart Association Task Force on Clinical Data Standards (ACC/AHA/HRS Writing Committee to Develop Data Standards on Electrophysiology), Buxton AE, Calkins H, et al. ACC/AHA/HRS2006 key data elements and definitions for electrophysiological studies and procedures: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Data Standards (ACC/AHA/HRS Writing Committee to Develop Data Standards on Electrophysiology).Circulation.2006;114(23):2534-2570.
[4]Centers for Disease Control and Prevention (CDC).State-specific mortality from sudden cardiac death-United States,1999. MMWR. Morbidity and mortality weekly report. 2002;51(6):123-126.
[5]Zheng ZJ, Croft JB, Giles WH, Mensah GA. Sudden cardiac death in the United States, 1989 to 1998. Circulation. 2001;104(18):2158-2163.
[6]Chugh SS, Jui J, Gunson K, et al. Current burden of sudden cardiac death: multiple source surveillance versus retrospective death certificate-based review in a large U.S. community. Journal of the American college of cardiology. 2004;44(6):1268-1275.
[7]郭继鸿. 中国心脏性猝死现状与防治 [J]. 中国循环杂志,2013(5).
[8] Malta Hansen C, Kragholm K, Pearson DA,etal. Association of Bystander and First-Responder Intervention With Survival After Out-of-Hospital Cardiac Arrest in North. Carolina, 2010-2013. JAMA. 2015;314(3):255-264.
[9]Nakahara S, Tomio J, I chikawa M,etal. Association of Bystander Interventions With Neurologically Intact Survival Among Patients With Bystander - Witnessed Out-of-Hospital Cardiac Arrest in Japan. JAMA. 2015;314(3):247-254.
[10]Priori SG, Blomström - Lundqvist C, Mazzanti A, etal. 2015ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). End orsed by: Association for European Paediatric and Congenital Cardiology(AEPC). European heart journal. 2015;36(41):2793-2867.
[11]Russo AM, Stainback RF, Bailey SR, etal. CCF/HRS/AHA/ASE/HFSA/SCAI/ SCCT / SCMR 2013appropriate use criteria for implantable cardioverter-defibrillators and cardiac resynchronization therapy: a report of the American College of Cardiology Foundation appropriate use criteria task force, Heart Rhythm Society, American Heart Association, American Society of Echocardiography, Heart Failure Society of America, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society for Cardiovascular Magnetic Resonance. Journal of the American College of Cardiology. 2013;61(12) :1318-1368.
[12]Al-Khatib SM, Stevenson WG, Ackerman MJ,etal.2017 AHA/ACC/ HRS Guideline For Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society.Journal of the American College of Cardiology. 2018;72(14):e91-e220.
[13]中华医学会心电生理和起搏分会,中国医师协会心律学专业委员会. 植入型心律转复除颤器临床应用中国专家共识(2021)[J].中华心律失常学杂志,2021(4).
[14]中华医学会心电生理和起搏分会,中国医师协会心律学专业委员会.2020 室性心律失常中国专家共识(2016共识升级版)[J].中国心脏起搏与心电生理杂志,2020(3).
[15]Chung MK, Szymkiewicz SJ, Shao M, etal.Aggregatenational experience with the wearable cardioverter-defibrillator:event rates,compliance,and survival. Journal of the American College of Cardiology. 2010,56(3):194-203.
[16]Epstein AE, Abraham WT, Bianco NR,etal. Wearable cardioverter-defibrillator use in patients perceived to beat high risk early post-myocardial infarction. Journal of the American College of Cardiology. 2013, 62(21):2000-2007.
[17]Ellenbogen KA, Koneru JN, Shar ma PS, etal. Benefit of the wearable cardioverter - defibrillator in protecting patients after implantable-cardioverter defibrillator explant: results from the National Registry. JACC. Clinical electrophysiology, 2017, 3(3):243-250.
[18]Olgin JE,Pletche rMJ, Vittinghoff E,etal.Wearable Cardioverter - Defibrillator after Myocardial Infarction. The New England journal of medicine. 2018; 379:1205.
[19]Masri A, Altibi AM, Erqou S, et al. Wearable Cardioverter-Defibrillator Therapy for the Prevention of Sudden Cardiac Death: A Systematic Review and Meta Analysis. JACC. Clinical electrophysiology, 2019; 5:152.
[20]华伟,杨杰孚,王玉堂,等.可穿戴式除颤器中国多中心临床观察性研究[J].中华心律失常学杂志,2020,24 (01): 41-46.
[21]Piccini JPSr, AllenL A, Kudenchuk PJ,etal. Wearable Cardioverter-Defibrillator Therapy for the Prevention of Sudden Cardiac Death: A Science Advisory From the American Heart Association. Circulation. 2016;133:1715.
[22]Rompianesi, Gianluca, et al. "Artificial intelligence in the diagnosis and management of colorectal cancer liver metastases." World Journal of Gastroenterology 28.1 (2022): 108.
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。