24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

额温枪(红外线测温仪)针对量测人体额温基准设计,使用非常简单、方便。1秒可准确测温,无镭射点,免除对眼睛之潜在伤害,不需接触人体皮肤,避免交叉感染,一键测温,排查流感。随着全球各地都确诊新冠疫情的情况下,小编收集了各国的额温枪准入要求,以供相关企业人员查询,如果您在注册过程中遇到一些问题,欢迎咨询我们的客服人员,将尽快安排人员回复,愿在特殊时期运用专长,尽一份绵薄之力。

1、中国
依据NMPA 2017年8月发布的《医疗器械分类目录》,07-03-04体温测量设备,产品描述:用红外方法测量临床测量患者体温,通常用于测量患者耳道、额头部位温度;产品为Ⅱ类医疗器械,由生产企业所在的省级食品药品监督管理局审查、批准。
产品认证流程:
(1)依据产品《技术要求》委托CNAS授权的各省医疗器械检测所进行产品的测试;
(2)准备注册文件,结合各公司实际生产情况和型式试验报告编写;额温计产品已列入豁免临床的产品目录(最新编号353),但需要提供精确度验证报告(依据GB/T 21417-1:2008);
(3)注册文件齐全后向省药监局申报,省药监局受理;
(4)药监局审理注册文件的同步,派出审核官对制造商进行现场质量体系考核;
(5)制造商收到注册证书后准备生产许可证申请资料,一般向市市场监督管理局申请颁发生产许可证书。
其他
资料清单:《医疗器械注册申请表》、证明性文件、医疗器械安全有效基本要求清单、综述资料、研究资料(重点:需软件验证和寿命周期验证)、生产制造信息、临床评价资料、产品风险分析资料、产品技术要求、产品注册检验报告、产品说明书及最小销售单元的标签样稿、符合性声明、申办人身份证证明资料、质量体系考核申请文件等;
时间:注册检验3个月(需要EMC试验)+注册审批4个月(含现场质量体系考核)+生产许可证审批1个月=8个月(正常审批状态);
费用:各省情况不一,一般各省直属检测中心正常型检不收费,注册费目前大部分省市有收费,可检索各省市药监局注册收费情况。

2、美国
依据美国FDA分类:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPCD/classification.cfm
对关键词“thermometer”进行查询

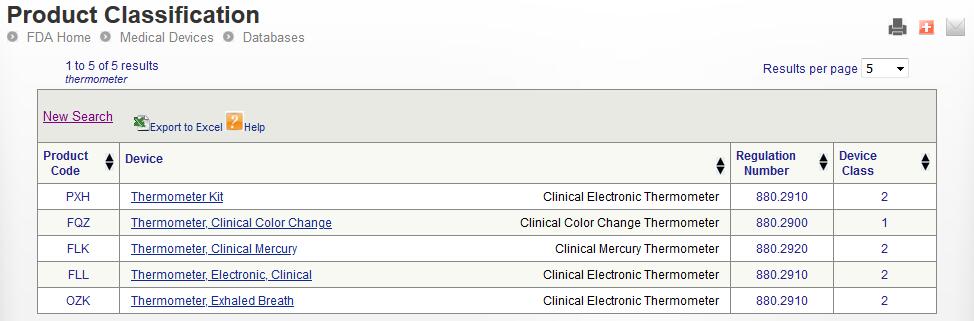
选择合适的代码:

依据FDA指南编写510k报告,提交美国FDA审批。
关键技术点:
(1)产品的性能测试包括:IEC60601-1:2005+A1:2012,IEC60601-1-2:2014,IEC60601-1-11:2015,ISO80601-2-56:2017/ ASTM_E1965-98_2016 ;外壳塑料件及显示屏等需要满足ISO10993-5:2009,ISO10993-10:2010生物学测试;
(2)依据ASTM_E1965-98_2016专标验证需要进行产品精确度验证,采集相关临床数据信息与水银温度计,已获批510k的电子体温计、额温计等进行数据对比统计分析;
(3)费用及周期:美国FDA 510k审核费,2020年正常官方费用:$11,594,小规模企业可申请优惠:$2,899;正常周期,启动项目至审批10个月左右;

3、欧盟
依据Regulation(EU)2017/745 on medical devices即MDR;依据Annex VIII分类规则10,IIa,需要公告参与审核体系ISO13485:2016及CE技术文件。
关键技术点
(1)产品的性能测试包括:IEC60601-1:2005+A1:2012,IEC60601-1-2:2014,IEC60601-1-11:2015,ISO80601-2-56:2017;外壳塑料件及显示屏等需要满足ISO10993-5:2009,ISO10993-10:2010生物学测试;
(2)依据ISO80601-2-56:2017专标验证需要进行产品精确度验证,采集相关临床数据信息与水银温度计,已通过CE认证的电子体温计、额温计等进行数据对比统计分析;
(3)费用及周期:由于欧盟采用的是委托具备资质的第三方公告机构监管方式,审核并颁发证书,相关费用以NB机构报出的为准;鉴于目前已获得资质的10家机构还未全面进行业务受理,周期不得而知,依据MDD的经验,预计12-15个月左右。

4、韩国
当前韩国疫情蔓延趋势严重,询问韩国KFDA注册的较多,重点介绍一下韩国注册的相关要求:
韩国医疗器械准入的法规门槛,基本分类为Ⅰ、Ⅱ、Ⅲ、Ⅳ类,持证为韩国公司(License holder),且韩代职责较重,如:快速通关、快速到门的服务、仓库管理,包括韩国保址部所有监管事宜而且在海关业务的应急时间等全链条内容,接受KGMP定期评审等。
KFDA的等级标准
(1)等级Ⅰ:非接触人体的或无潜在危险性的产品;
(2)等级Ⅱ:对人体具有一定的危险性但对人体生命的危险及造成的影响和危险性比较低的产品;
(3)等级Ⅲ:一定时间内插入人体使用或潜在的危险性比较高的产品;
(4)等级Ⅳ:永久的移植到人体内或直接接触到心脏、中枢神经神经等而使用的产品;
相关流程

韩国注册相关内容:
(1)申请KGMP证书和接受现场审核;
(2)对于Ⅱ类产品一般是委托授权的第三方审核员完成审核(但笔者前期服务的案例中,也都是韩国保址部官员),若为Ⅲ、Ⅳ类产品则由韩国保址部(相当于中国药监局)自行审核,并获得KGMP证书;
(3)寄送样品到韩国MFDS授权的实验室进行韩标的测试;
(4)由韩代向MFDS提交技术文件(包括TCF、检测报告、KGMP证书等),同时还需要向韩国保址部缴纳申请费,后续由该机构进行注册文件的审核,最终获得批准,后续方可入市。额温枪属于韩国Ⅱ类产品,预计周期6-9个月。
证书信息参考

【声明】文章额温枪图片来源网络,如有侵权,请联系删除。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。