24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

临床评价是在不降低对于安全性和有效性要求的基础上,用科学评价的结论来替代临床试验,替代的是:不是必须进行的临床试验,这样可以减少监管机构以及医疗器械研发和生产企业的负担,降低不必要的人体试验的数量。

临床评价在产品的整个生命周期里的哪个阶段进行的呢?
我国现行的导则下,临床评价主要是为注册申报资料做准备的。研发之后的注册备案、注册资料准备阶段,进行的上市前的临床评价。在欧盟,除了上市前的临床评价,上市后根据风险程度的不同,也会要求按照一定的频率进行上市后的临床评价。1月2日,征求意见稿的导则提出了全生命周期临床评价的概念,预示着我国和欧盟和全球的法规日渐趋同,同样也会面临着医疗器械上市后也需要进行评价的趋势。
临床评价概念非常大,涵盖了通常所说的同品种临床评价包括豁免目录的临床评价和临床试验。通过临床文献资料、临床经验数据、临床试验等信息的收集和分析来对产品是否满足使用的要求以及适用范围来进行确认的过程。
临床评价应用范围广,上述介绍的产品上市前后都需要临床评价,新产品的注册和产品的变更注册都会遇到临床评价。
我国医疗器械分类
我国医疗器械按照风险程度划分为一、二、三类,风险程度依次增高。对于一二三类医疗器械的临床评价路径有所不同,先了解一下临床评价路径分析思维导图,下方详细分析。
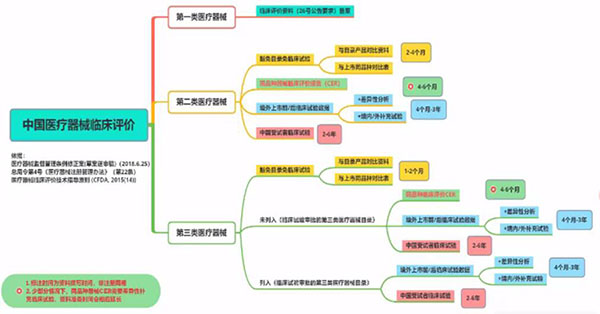
各类医疗器械产品临床评价路径可选项分析
第一类临床评价路径:按照26号公告的要求,进行临床资料的准备和备案。
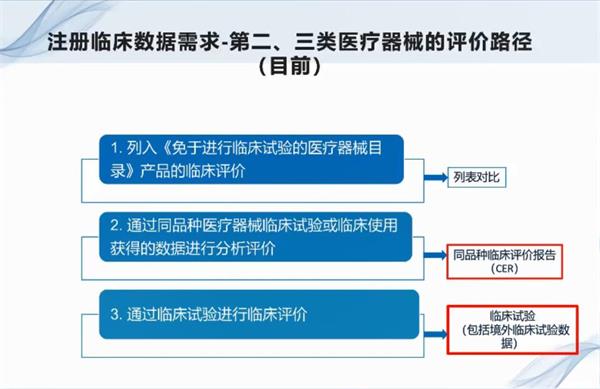
第二类临床评价路径(优到劣):(1)豁免目录路径;(2)同品种临床评价报告路径;(3)临床试验路径。
(1)豁免目录路径:是否已在颁布的豁免目录里,如果在,按照要求与豁免目录要求与目录产品进行对比撰写对比资料,与上市的同品种来撰写相应的对比资料。与其他两种路径对比,准备的时间较短,大致需要2-4个月时间。可能随着产品难易程度的不同,也有可能1个月,也有可能6个月。
(2)同品种临床评价报告路径:什么产品适合走临床评价报告路径?我们将在后期分享。该路径筹备周期在4-6个月时间,随着产品难易程度的不同,简单的2-3个月,难度大的甚至比6个月更长。
(3)临床试验路径(两种):中国受试者的临床试验:随着新版GCP的颁布,要求越来越严格。大概周期需要2-6年的时间。境外临床试验数据指导原则:可以选取申报产品在境外上市前或上市后的临床试验数据作用注册资料的准备,同时准备国内差异性分析或者是境内境外补充临床试验来通过境外临床试验数据路径来申报。资料准备周期,短的与同品种临床评价报告路径相似,长的相当于小型或中型的临床试验,整体需要大概4个月到3年甚至更长的时间。
第三类临床评价路径(优到劣):三类医疗器械监管更加严格,我国有必须进行临床试验审批的第三类医疗器械目录,包含八大类的产品。如何判定三类医疗器械进行哪种临床评价路径呢?
(1)豁免目录路径:是否在豁免目录内,如果是,按照豁免目录途径进行准备。
如果它在必须进行临床试验审批的目录里,有两种路径可选择:1、境外临床试验数据路径,与二类产品考虑方式相同。2、中国受试者临床试验。
(2)同品种临床评价报告路径:
如果我的产品既不在豁免目录也不在必须进行临床试验审批目录里,可以优先考虑同品种临床评价路径。
对于没有列入必须进行临床试验审批目录的三类医疗器械,首选考虑的是同品种临床评价路径,因为该路径准备资料的周期是最短的。如果该路径无法进行,优先再考虑境外临床试验数据路径,查看该产品是否有在境外上市前或上市后的临床试验数据,按照这个导则来进行相应的资料的准备。
(3)临床试验路径:
虽然没有列入必须进行临床试验审批目录中,但是它没有办法进行同品种临床评价,或者也没有办法通过境外临床试验数据路径来进行申报时,就必须考虑进行中国受试者的临床试验了。
以上就是目前一二三类医疗器械在中国临床评价路径的可选项。需要补充的一点:临床同品种评价报告个别的情况下,会遇到需要补充临床试验的情况,该情况下准备资料的周期也相应延长。

豁免临床产品的性能对比问题解答:
1、进口产品在国外已经上市,现准备在国内注册申报,走同品种比对,同类产品名都说了。在同品种比对中,如果找的文献分别是对申报产品及对比产品进行研究,那是否我还要结合文献进行比对?文献上有临床资料~但比如我们产品是A,同类产品是B,这些文献要么只有A的数据,要么只有B的数据~
答:文献不用,那你就对比临床豁免目录,和对比同类B产品不就好了。在豁免目录里面的不用走同品种,同品种很麻烦的,很少有走的,走这个的话要写好多资料,而且都要好专业的才能写。写完大概1500页,同品种都是有局限的,不是所有产品都可以走,同品种首先是能找到资料才敢写,很多都不能走,都要去做临床。
2、对比产品的性能指标对于免临床产品来说也是这么硬性的要求吗? 答:主要是要能证明产品是同品种,产品等同且安全有效。
3、豁免临床的产品同品种对比中性能的对比,如果买不到竞品也找到公开的数据,大家都是怎么做的?豁免临床的临床评价不需要做性能指标的对比吗?
答:那就按照豁免的相关证明材料做临床评价,如果再找不到2-5篇高质量文献,真是要做临床了。不过一般免临床产品都是已上市的成熟产品,市场上产品资料应该能找到。说明书、网站、文献和注册检验报告,公开的资料都搜一遍。这样搜一遍,如果不能提供非常充分、有效的证明材料,最后还是要做临床。这样既耽误了时间,又浪费精力。根据经验,这种一般都不会过,折腾一大圈,最后还得做临床。注册检报告比拿到技术要求还难,性能指标的对比,一般情况只有技术要求和注册检报告上面才有。如果没有拿到竞品的技术要求或注册检报告,性能指标怎么对比?那就没法对比了。
3、找不到竞品的性能指标就只能做临床了吗? 答:是的
临床评价相关文章推荐:
浅谈医疗器械临床评价途径
临床评价报告撰写服务
医用一次性使用防护服注册临床评价案例
同品种医疗器械对比临床评价报告给企业带来的机遇
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。