24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

一、产品概述
(一)产品结构及组成
青光眼引流器由青光眼引流支架和传输装置组成,其中青光眼引流支架由镍钛合金制成。产品经辐照灭菌,一次性使用。货架有效期2 年。
(二)产品适用范围
该产品适用于在静态房角镜下,房角完全开放,单纯用药效果不佳或不能用药;同时房角激光治疗不能控制病情进展,或医生判断不宜开展或无法开展房角激光治疗;不能耐受传统滤过性手术的原发性早中期开角型青光眼患者配合白内障手术降低眼压(IOP)。
(三)型号/规格
FOOO22
(四)工作原理
青光眼引流器旨在通过小梁网为房水流出提供旁路,提供大约90度的Schlemm管扩张。植入后,青光眼引流器支架提供支撑结构,用于撑开和恢复通过Schlemm管的天然房水外流路径,从而降低眼内压。
二、临床前研究概述
(一)产品性能研究
1.产品技术要求研究
产品技术要求研究项目如表1所示。
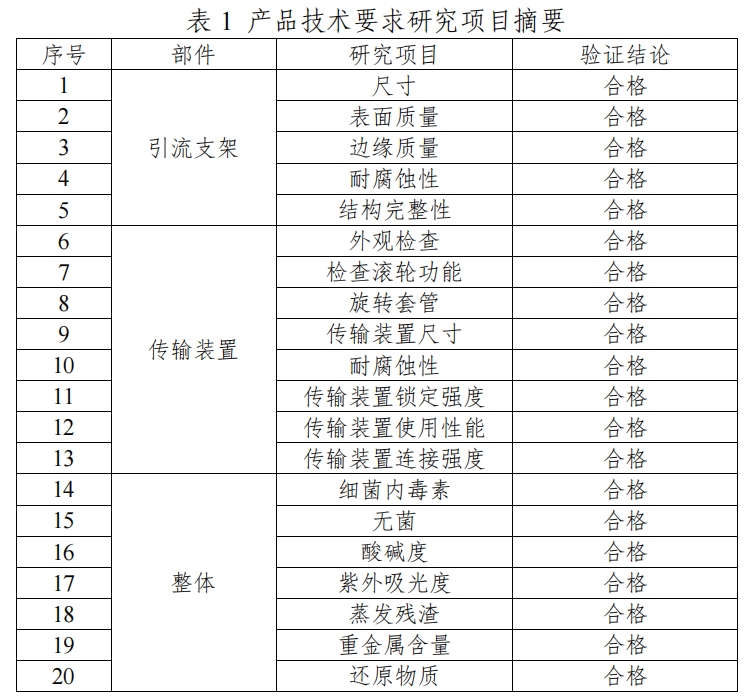
2.产品性能评价
产品性能评价包括上表所列项目以及奥氏体完成转变温度、磁共振成像兼容性、有限元分析、可沥滤物研究、镍洗脱、水解稳定性、尸体角膜边缘模拟使用、尸眼防水流畅系数等。
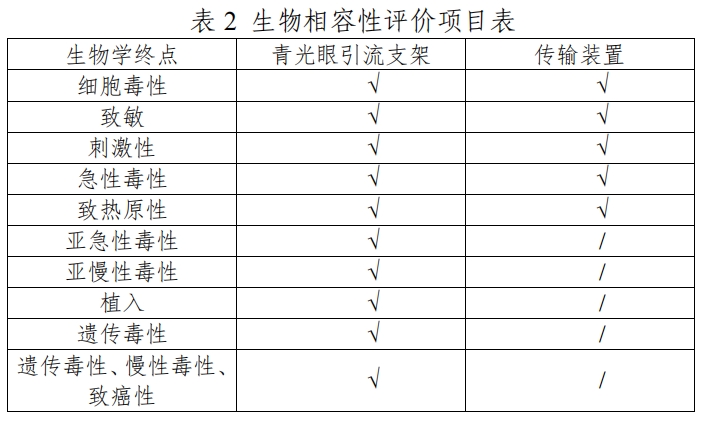
(二)生物相容性该产品组成中,青光眼引流支架属于与组织持久接触的植入器械,传输装置与组织短期接触的外部接入器械。申请人按照GB/T16886系列标准对青光眼引流支架和传输装置进行了生物学评价,具体的评价项目见表2。产品的生物相容性风险可接受。
(三)灭菌
产品采用辐射灭菌,无菌状态提供。申请人提供了灭菌确认报告,证明无菌保障水平为10-6。
(四)产品有效期和包装
产品货架有效期为2 年。申请人提供了加速老化和实时老化货架有效期研究资料,包括产品稳定性、包装完整性和模拟运输验证等。
(五)动物研究申请人开展了食蟹猴的眼植入试验,评价指标包括眼底检查、IOP测量、扫描电镜和光学显微镜等观察。结果显示术后所有动物的IOP恢复至正常范围,植入眼组织未发生形态学变化,植入物在眼前房中具有良好的耐受性。
三、临床评价概述
申请人选取临床试验路径开展临床评价,提交了境外临床试验资料。临床试验设计为前瞻性随机、优效、平行对照设计,试验组为白内障手术伴申报产品植入,对照组为白内障手术,拟纳入556例受试者(试验组369例、对照组187例)。主要有效性终点是药物洗脱后24个月时,平均昼间眼压较基线水平下降至少20%的眼睛比例,同时,还将试验组的24个月时的应答率与目标比率(50%)进行比较。次要评价指标为眼压的平均变化。安全性评价指标主要为不良事件。
临床试验结果显示术后24个月药物洗脱后评估时,试验组和对照组平均未用药相较基线降低的比例分别为77.2%和57.8%,差值为19.5%,95%可信区间为(11.2%,27.8%),下限大于优效性界值0,试验组24个月时应答率95%置信区间(72.6%,81.4%),下限大于目标比率(50%),术后24个月未用药治疗评估时,试验组与基线相比未用药平均日间眼压降幅为7.5mmHg,对照组为5.3mmHg,组间具有统计学差异。安全性结果显示试验组和对照组不良事件无显著差异。申请人还提交了申报产品上市后随访至5年的临床数据,在试验组的308例可用受试者中,201例保持非药物控制状态,平均眼压为16.6mmHg;在对照组中,61例受试者保持非药物控制状态,平均眼压为17.6mmHg。试验组眼压平均降低8.3mmHg,对照组眼压平均降低6.5mmHg。两组安全性结果未见显著差异。
综上,临床评价资料符合目前审评要求。
四、产品受益风险判定
该产品的受益:在静态房角镜下,房角完全开放,单纯用药效果不佳或不能用药,同时房角激光治疗不能控制病情进展,或医生判断不宜开展或无法开展房角激光治疗,不能耐受传统滤过性手术的原发性早中期开角型青光眼患者配合白内障手术降低眼压(IOP)。
该产品存在的风险:该产品使用过程中可能出现的不良事件如引流器错位、眼内压升高、前房积血和眼部炎症等。根据申请人提供的申报资料,经综合评价,在目前认知水平上,认为该产品的上市为适用人群带来的受益大于风险。为保证用械安全,基于对主要剩余风险的规避,需在说明书中提示以下信息:
(一)产品适用范围
该产品适用于在静态房角镜下,房角完全开放,单纯用药效果不佳或不能用药;同时房角激光治疗不能控制病情进展,或医生判断不宜开展或无法开展房角激光治疗;不能耐受传统滤过性手术的原发性早中期开角型青光眼患者配合白内障手术降低眼压(IOP)。
(二)警告及注意事项
1.警告
(1)需要透明介质进行充分可视化。以下条件可能会妨碍安全成功植入青光眼引流器所需房角的充分可视化:角膜雾状混浊,角膜混浊或任何其他可能影响前房角镜观察预期植入物位置的条件。
(2)外科医生应在手术前进行房角镜检查,以排除先天性房角异常、周边虹膜前粘连(PAS)、房角闭合、青光眼前期的虹膜红变和任何其他可能导致支架放置不当并造成危险的房角异常。
(3)外科医生应在术后监测患者是否保持适当的眼压(IOP)。如果术后眼压保持情况不良,医生应考虑采用适当的额外治疗方法方案来降低眼压。
(4)医生应通过前房角镜检查定期监测青光眼引流器的状态,以评估PAS的发展情况、入口阻塞情况、迁移情况或器械虹膜或器械角膜的接触情况。建议创建植入器械的基线照片文档。在关键性试验中,无论是否存在PAS,最快可在术后1 周至24个月内观察到阻塞情况。
(5)青光眼引流器的植入术可联合白内障手术进行,但可能会影响角膜健康。因此,对于眼部存在明显角膜受损(例如,Fuch's角膜营养失调、角膜滴状物或角膜内皮细胞密度低)或白内障手术后存在角膜受损风险因素(例如,老龄化、致密核性白内障硬化)的患者应进行明确警告。
(6)青光眼引流支架由镍钛(镍钛诺)合金组成。一般而言,此材料没有危险。对镍过敏的人可能对该器械产生过敏反应,有金属过敏史的人需尤其谨慎。一些受试者可能在植入该器械后才开始对镍产生过敏反应。某些过敏反应可能很严重。
2.注意事项
(1)尚不确定在以下情况或条件下青光眼引流器的安全性和有效性:
Ÿ21岁或以下。
Ÿ眼部先前有过重大创伤。
Ÿ前房异常。
Ÿ眼部有慢性炎症。
Ÿ患有与血管病症相关的青光眼。
Ÿ眼内已植入人工晶体。
Ÿ患有葡萄膜炎性青光眼。
Ÿ患有假性剥脱性或色素性青光眼。
Ÿ眼睛患有其他继发性开角型青光眼。
Ÿ眼睛曾接受过切口青光眼手术或睫状体消融手术。
Ÿ眼睛曾接受过氩激光小梁成形术(ALT)。
Ÿ未经药物治疗时眼压(IOP)<22mmHg或>34mmHg。
Ÿ经过药物治疗后眼压(IOP)>31mmHg的眼睛。
Ÿ眼睛在术前需要使用4种以上眼压降压药物。
Ÿ在接受复杂的白内障手术时,眼前房或眼后房出现医源性损伤。
Ÿ当植入不伴有白内障手术和人工晶状体植入时。
(2)尚不确定使用多个青光眼引流器的安全性和有效性。
(3)尚未被确定为药物治疗青光眼的替代方案。
(4)如果在手术过程中的任何时间插入青光眼引流器时遇到阻力过大,请停止使用该器械。插入过程中,抗阻插入青光眼引流器可能导致患者受伤或青光眼引流器损坏。
(5)重新定位也无法克服一些解剖学限制带来的问题,并且不得再反复尝试植入。
(6)使用前,检查青光眼引流器的无菌包装及青光眼引流器本身,以确认器械或包装没有损坏。如果器械或包装受损,请勿使用本产品。
(7)应将患者信息卡交给患者,并提醒患者妥善保存好此卡,作为永久记录提供给以后为患者诊治的任何医务工作者。
(三)禁忌证
在以下情况或条件下禁用青光眼引流器:
1.闭角型青光眼。
2.创伤性、恶性、葡萄膜炎或新生血管性青光眼或可辨前房(AC)角先天性异常的患者。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。