24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
一、产品概述
(一)产品结构及组成
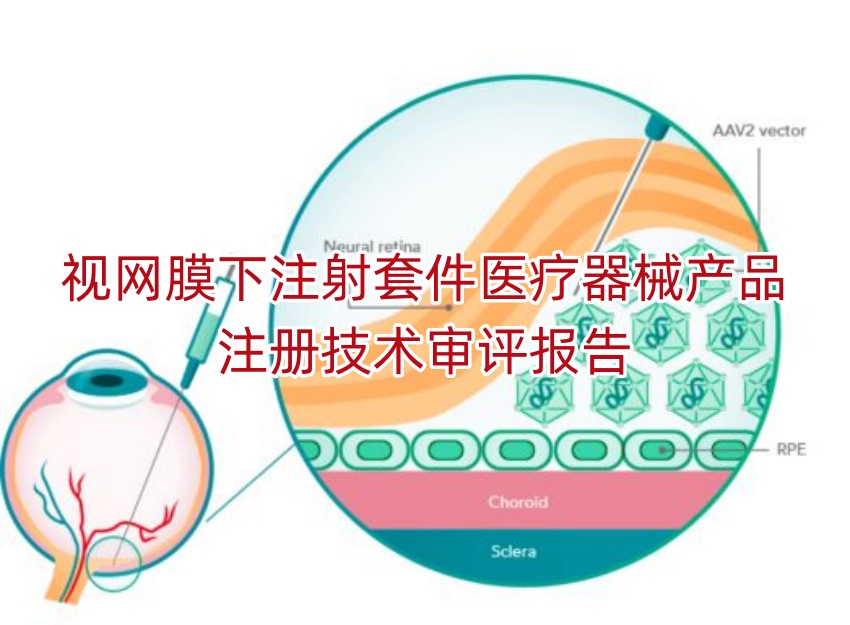
视网膜下注射套件(简称“注射套件”)由注射套管和延长管组成,为眼科注射而设计。
套管有一个安装在鲁尔(又称“锥型”)接头中的不锈钢管,套管可以通过接头连接到延长管。不锈钢管的外径为0.51mm(25G)。由聚酰亚胺制成的第二管安装在不锈钢管内,形成锥形套管。聚酰亚胺管是柔性的,外径为0.12mm(38G),内径为0.10mm(41G)。
延长管由一段15cm的软管制成,管两端分别有鲁尔接头,可以连接到注射器以进行注射。鲁尔接头由聚碳酸酯制成,延长管由PVC制成。
视网膜下注射套件经伽马辐射进行灭菌,货架有效期为5年。
(二)产品适用范围
该产品用于眼科手术中视网膜下注射、抽吸。
(三)型号/规格
3319PolyTipCannula25/38gSet
(四)工作原理
该注射套件包括两个主要组件,它们共同工作用于眼科手术中注液、放液、冲洗,包括用于在视网膜下注射液体。注射套件由连接到延长管的专用眼科套管组成。可以将延长管连接到包含待注射液的标准注射器(未包括在本次申报内)。
二、临床前研究概述
(一)产品性能研究
1.产品技术要求研究
产品技术要求研究项目如表1所示。

2.产品性能评价
申请人在产品设计确认和验证阶段完成了以下性能研究:流量、延长管无泄漏、延长管与鲁尔接头之间的连接强度、模拟注射试验、药物相容性试验,研究评价结果全部合格。此外,与对比产品进行了流量测试、针管泄漏、柔韧性和穿刺力的性能对比研究,证明两者具有类似的使用性能综合以上性能研究结果,可以判定申报产品符合设计指标,满足预期用途的要求。
(二)生物相容性
该产品为外部接入器械,与组织短期接触。申请人依据GB/T 16886系列标准进行了生物相容性评价,包括热原、皮内注射、急性全身毒性、致敏、细胞毒性。产品生物学风险可接受。
(三)灭菌
该产品无菌状态提供,采用钴60辐照灭菌。申请人提供了申报产品灭菌确认报告,辐照剂量25-40kGy,无菌保证水平为10-6。
(四)产品有效期和包装
产品包装在一个由PETG制成的刚性托盘中。一个由特卫克1073B制成的“盖子”被热密封到托盘上,形成主包装(无菌屏障)。
申请人提供了5年加速老化验证报告,包括产品稳定性和包装完整性,同时提交了模拟运输试验报告。研究结果支持申报产品的货架有效期。
三、临床评价概述
该产品选取同品种路径开展临床评价,选取已上市的Bausch&Lomb的一次性使用眼科套管(国械注进20152164183)作为同品种产品进行临床评价。与同品种产品在适用范围(适应证、适用人群、适用部位、与人体接触的方式和时间、疾病的严重程度和阶段、使用条件、重复使用、使用方法、禁忌证、警告及预防措施等)、工作原理、器械设计特征、材料、结构组成、型号规格、产品性能,生物学特性等方面进行了比对,申报产品为视网膜下注射套件用于注射,设计用于在眼科手术中注液、放液、冲洗。对比器械用于在眼外科手术过程中进行破囊、注射、放液和冲洗操作;两者针管头端材料和尺寸存在差异,申报产品针管头端由聚酰亚胺制成,聚酰亚胺材质较硬,头端设计较长较细(L:5mm,D:0.12mm)。对照产品B&L套管头端由硅胶制成,相对较为柔软,较短而粗(L:1.5mm,D:0.36mm)。针对差异,申请人提交了性能对比测试(包括穿刺力、柔韧性,畅通性和防泄漏性),结果显示两种器械针管都可无弯折地可刺穿视网膜。同时,申报产品的针管头端所需穿透力小且遗留的开口较小、边缘整齐,申报产品的头端更细小,流量较小。申请人还提交了申报产品用于视网膜下注射及抽吸的临床数据。此外,申请人提交了同品种产品上市后的临床数据。
综上,申请人提供的临床评价资料符合目前的临床审评要求。
四、产品受益风险判定
根据风险管理相关规定,对产品进行了风险受益分析,识别出产品的潜在风险,对单个风险以及单个风险的组合的影响进行了评估,采取了相应的风险控制措施并对风险控制措施的有效性进行了验证。经评估,与产品的受益相比,产品整体剩余风险可接受。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。