24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
医疗器械的研发与生产,作为医疗健康领域的重要一环,其过程中的每一个环节都必须遵循严格的标准和规范,以确保最终产品的安全性和有效性。特别是在注册阶段,企业必须证明其研发与生产设施满足特定条件,这是获得市场准入的先决条件之一。本文将探讨医疗器械注册人企业在选择研发场地时的共用与独立使用问题,基于《医疗器械注册质量管理体系核查指南》的规定,为读者提供详实的指导和见解。
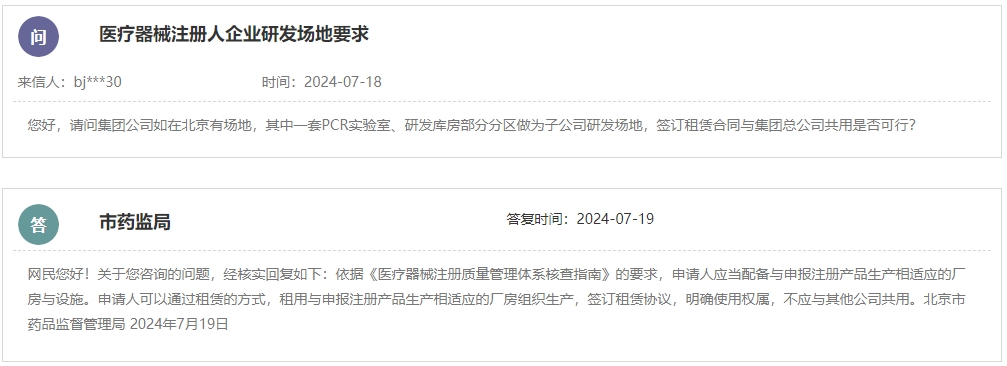
医疗器械注册人企业研发场地要求
依据《医疗器械注册质量管理体系核查指南》,申请人即医疗器械注册人企业,必须配备与申报注册产品生产相适应的厂房与设施。这意味着研发场地必须满足以下几点要求:
集团公司共享资源的考量
在集团公司的框架下,资源共享是一种常见的管理模式,尤其是在研发资源较为集中的情况下。然而,当涉及到医疗器械注册人企业的研发场地时,这种共享模式却受到一定的限制。具体而言,《医疗器械注册质量管理体系核查指南》明确指出,申请人可以通过租赁方式租用与申报注册产品生产相适应的厂房组织生产,但不应与其他公司共用场地。
共用场地的局限性
尽管共用场地在一定程度上可以节省成本,促进资源的高效利用,但在医疗器械研发与注册的背景下,共用场地可能带来的问题不容忽视:
实践案例:PCR实验室与研发库房共用问题
假设一家位于北京的集团公司拥有符合医疗器械研发要求的PCR实验室和研发库房,其子公司希望租用这部分场地进行自身产品的研发工作。在这种情况下,尽管签订租赁合同看似合理,但从监管角度来看,子公司与母公司共用场地并不被《医疗器械注册质量管理体系核查指南》所允许。这是因为共用场地可能难以满足独立性要求,从而影响到注册流程的顺利进行。
结论与建议
对于医疗器械注册人企业而言,选择独立的研发场地是遵守《医疗器械注册质量管理体系核查指南》的必要条件。尽管在集团内部共享资源可以带来经济效益,但在研发场地的选择上,独立性是首要考虑的因素。企业应当确保研发场地的独立使用权,避免与其他实体共用,以确保注册产品的质量和合规性。在实际操作中,企业应详细评估场地的适应性和独立性,通过正式的租赁协议明确使用权属,为医疗器械的注册奠定坚实的基础。这一决策不仅关乎企业的短期利益,更影响到长期的市场竞争力和品牌信誉。
在医疗器械行业日益严格的监管环境下,企业必须更加注重合规性和质量控制,确保每一项研发和生产活动都符合最高标准,以保障患者的安全和健康。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。