24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

总则
一、《中华人民共和国药典》(简称《中国药典》)依据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》等有关法律法规制定和颁布实施。《中国药典》一经颁布实施,其所载同品种或相关内容的历版药典标准或原国家药品标准即停止使用。
《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药,二部收载化学药品,三部收载生物制品及相关通用技术要求,四部收载通用技术要求、指导原则和药用辅料。除特别注明版次外,《中国药典》均指现行版。
本部为《中国药典》二部。
二、《中国药典》主要包括凡例、品种正文、通用技术要求和指导原则。
凡例是正确使用《中国药典》的基本原则,是对品种正文、通用技术要求以及药品质量检验和检定中有关共性问题的统一规定。
品种正文为各品种项下收载的内容。
通用技术要求包括《中国药典》收载的通则和总论等。
指导原则系指为规范药典执行,指导药品标准制定和修订,提高药品质量控制水平所制定的推荐性技术要求。
三、药品标准由凡例、品种正文及其引用的通用技术要求共同构成。
本版药典收载的凡例与通用技术要求对未载入本版药典的其他药品标准具有同等效力。
四、凡例和通用技术要求中采用“除另有规定外”这一用语,表示存在与凡例或通用技术要求有关规定不一致的情况时,则在品种正文中另作规定,并按品种正文执行。
五、品种正文所设各项规定是针对符合《药品生产质量管理规范》(GoodManufacturingPractices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》未检出其添加物质或相关杂质,亦不能认为其符合规定。
六、《中国药典》的英文名称为Pharmacopoeia ofthe People'sRepublicofChina;英文简称为ChinesePharmacopoeia;英文缩写为ChP。《中国药典》适时推出英文版,当出现歧义时,以中文版为准。
通用技术要求
七、通则主要包括制剂通则和通用检测方法等。制剂通则系指按照药物剂型分类,针对剂型特点所规定的基本技术要求。通用检测方法系指各品种进行相同项目检验时所应采用的统一规定的设备、程序、方法和限度等。
总论是对某一类生物制品质量控制的相关技术要求。
品种正文
八、品种正文系根据药物自身的理化与生物学特性,按照来源、处方、制法和运输、贮藏等条件所制定的、用以评估药品质量在有效期内是否达到药用要求,并衡量其质量是否均一稳定的技术要求。
九、品种正文根据品种和剂型的不同,按顺序可分别列有:
(1)品名(包括中文名、汉语拼音与英文名);(2)药物的结构式;(3)分子式、分子量与CAS编号;(4)来源或药物的化学名;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂;(16)标注;(17)杂质信息等。
原料药与制剂中已知杂质的名称与结构式等信息一般均在原料药正文中列出,相应制剂正文直接引用。复方制剂中活性成分相互作用产生的杂质,一般列在该品种正文项下。
十、品种正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
名称与编排
十一、品种正文收载的药品中文名通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名均为法定名称;本部药典收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。
有机药物的化学名系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(InternationalUnionofPureandAppliedChemistry,IUPAC)的命名系统一致。
十二、药品化学结构式按照世界卫生组织(WorldHealthOrganization,WHO)推荐的“药品化学结构式书写指南”书写。
十三、品种正文按药品中文名笔画顺序排列,同笔画数的字按起笔笔形一丨丿、乛的顺序排列;单方制剂排在其原料药后面;放射性药品集中编排;索引按汉语拼音顺序排序的中文索引、英文名和中文名对照索引排列。
项目与要求
十四、制法项下主要记载药品的重要工艺要求和质量管理要求。
(1)所有药品的生产工艺应经验证,并经国务院药品监督管理部门批准,生产过程均应符合《药品生产质量管理规范》的要求。
(2)来源于动物组织提取的药品,其所用动物种属要明确,所用脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病地区的健康牛群;来源于人尿提取的药品,均应取自健康人群。上述药品均应有明确的病毒灭活工艺要求以及质量管理要求。
(3)直接用于生产的菌种、毒种、来自人和动物的细胞、DNA重组工程菌及工程细胞,来源途径应经国务院药品监督管理部门批准并应符合国家有关的管理规范。
十五、性状项下记载药品的外观、臭、味、溶解度以及物理常数等,在一定程度上反映其质量特性。
(1)外观性状是对药品的色泽和外表感观的规定,其中臭与味指药品本身所固有的,可供制剂开发时参考。
(2)溶解度是药品的一种物理性质。各品种项下选用的部分溶剂及其在该溶剂中的溶解性能,可供精制或制备溶液时参考;对在特定溶剂中的溶解性能需作质量控制时,在该品种检查项下另作具体规定。药品的近似溶解度以下列名词术语表示:
极易溶解系指溶质1g(ml)能在溶剂不到1ml中溶解;
易溶系指溶质1g(ml)能在溶剂1~不到10ml中溶解;
溶解系指溶质1g(ml)能在溶剂10~不到30ml中溶解;
略溶系指溶质1g(ml)能在溶剂30~不到100ml中溶解;
微溶系指溶质1g(ml)能在溶剂100~不到1000ml中溶解;
极微溶解指溶质1g(ml)能在溶剂1000~不到10000ml中溶解;
几乎不溶或不溶系指溶质1g(ml)在溶剂10000ml中不能完全溶解。
试验法:除另有规定外,称取研成细粉的供试品或量取液体供试品,于25℃士2℃一定容量的溶剂中,每隔5分钟强力振摇30秒钟;观察30分钟内的溶解情况,如无目视可见的溶质颗粒或液滴时,即视为完全溶解。
(3)物理常数包括相对密度、馏程、熔点、凝点、比旋度、折光率、黏度、吸收系数、碘值、皂化值和酸值等;其测定结果不仅对药品具有鉴别意义,也可反映药品的纯度,是评价药品质量的主要指标之一。
十六、鉴别项下规定的试验方法,系根据反映该药品某些物理、化学或生物学等特性所进行的药物鉴别试验,不完全代表对该药品化学结构的确证。
十七、检查项下包括反映药品的安全性与有效性的试验方法和限度、均一性与纯度等制备工艺要求等内容;对于规定中的各种杂质检查项目,系指该药品在按既定工艺进行生产和正常贮藏过程中可能含有或产生并需要控制的杂质;改变生产工艺时需另考虑增修订有关项目。
(1)采用色谱法检测有关物质时,杂质峰(或斑点)不包括溶剂、辅料或原料药的非活性部分等产生的色谱峰(或斑点)。必要时,可采用适宜的方法对上述非杂质峰(或斑点)进行确认。
(2)对于生产过程中使用或产生的有机挥发性化合物,应在后续的生产环节予以有效去除。药品中残留的有机挥发性化合物,药品生产企业均应按照残留溶剂通则(通则0861)的相关要求制定合理的检验方法以进行风险评估和控制,并符合相应有机挥发性化合物的限度要求。药品中已对残留的有机挥发性化合物进行风险评估及有效控制并符合残留溶剂通则(通则0861)限度要求的,可不再进行各论中品种正文规定的残留溶剂检查,其中第二类溶剂限度如需采用方法2进行确定,应经国务院药品监督管理部门批准后方可使用。
(3)对于生产过程中使用的原料药、辅料、生产设备、水和包装材料等可能引入的元素杂质,以及贮存过程中包装材料迁移引入药品的元素杂质,药品生产企业均应按照元素杂质通则(通则0862)的相关要求制定合理的检验方法以进行风险评估和控制,并符合相应元素杂质的限度要求。药品中已对元素杂质进行风险评估及有效控制并符合元素杂质通则(通则0862)限度要求的,可不再进行品种正文规定的重金属、砷盐等元素杂质检查,包括但不限于药品制剂、原料药的检验。
(4)对于生产过程中可能使用或产生的致突变机制的遗传毒性杂质,药品生产企业应对生产工艺等进行风险评估以确定形成遗传毒性杂质的可能性,必要时制定合理的检验方法以进行控制,限值应符合遗传毒性杂质控制指导原则(指导原则9306)等国务院药品监管部门相关指导原则的要求。
(5)处方中含有抑菌剂的注射剂和眼用制剂等,应建立适宜的检测方法对抑菌剂的含量进行控制。正文已明确列有抑菌剂检查的品种必须依法对产品中使用的抑菌剂进行该项检查,并应符合相应的限度规定。
(6)供直接分装成注射用无菌粉末的原料药,应按照注射剂项下相应的要求进行检查,并应符合规定。
(7)各类制剂,除另有规定外,均应符合各制剂通则项下有关的各项规定。
十八、含量测定项下规定的试验方法,用于测定原料药及制剂中有效成分的含量,一般可采用化学、仪器或生物测定方法。
十九、类别系按药品的主要作用与主要用途或学科的归属划分,不排除在临床实践的基础上作其他类别药物使用。
二十、制剂的规格,系指每一支、片或其他每一个单位制剂中含有主药的重量(或效价)或含量(%)或装量。注射液项下,如为“1ml:10mg”,系指1ml中含有主药10mg;对于列有处方或标有浓度的制剂,也可同时规定装量规格。
二十一、贮藏项下的规定,系为避免污染和降解而对药品贮存与保管的基本要求,通常可以使用下列名词术语表示:
遮光系指用不透光的容器包装,例如棕色容器或适宜黑色材料包裹的无色透明、半透明容器;
避光系指避免日光直射;
密闭系指将容器密闭,以防止尘土及异物进入;
密封系指将容器密封以防止风化、吸潮、挥发或异物进入;
熔封或严封系指将容器熔封或用适宜的材料严封,以防止空气与水分的侵入并防止污染;
阴凉处系指不超过20℃;
凉暗处系指避光并不超过20℃;
冷处系指2~10℃;
常温(室温)系指10~30℃。
除另有规定外,贮藏项下未规定贮藏温度的一般系指常温。
二十二、标注项下的规定,系指开展检定工作等所需的信息,应采取适宜的方式(如药品说明书等)注明。
二十三、制剂中使用的原料药和药用辅料,均应符合本版药典的规定;本版药典未收载的原料药,必须制定符合产品生产和质量控制要求的标准,并需经国务院药品监督管理部门批准;本
版药典未收载的药用辅料,应制定相应的标准,并符合国务院药品监督管理部门的有关规定。
同一原料药用于不同制剂(特别是给药途径不同的制剂)时,需根据临床用药要求制定相应的质量控制项目。
检验方法和限度
二十四、本版药典正文收载的品种,均应按规定的方法进行检验。采用药典规定的方法进行检验时,应对方法的适用性进行确认。如采用其他方法,应进行方法学验证,并与规定的方法比对,根据试验结果选择使用,但应以本版药典规定的方法为准。
二十五、本版药典中规定的各种纯度、限度数值和制剂的重(装)量差异,系包括上限和下限两个数值本身及其中间数值。规定的这些数值不论是百分数还是绝对数字,其最后一位数字都是有效位。
试验结果在运算过程中,可比规定的有效数字多保留一位数,而后根据有效数字的修约规则(GB/T8170-2008)进舍至规定有效位。计算所得的最后数值或测定读数值均可按修约规则进舍至规定的有效位,取此数值与标准中规定的限度数值比较,以判断是否符合规定的限度。
二十六、原料药、药用辅料、药材和饮片、植物油脂和提取物的含量(%),除另有注明者外,均按重量计。
中药制剂的含量,一般按每一计量单位(1片、1丸、1袋、1ml等)的重量计。
中药单一成分、化学原料药或药用辅料等如规定上限为100%以上时,系指用本版药典规定的分析方法测定时可能达到的数值,它为药典规定的限度或允许偏差,并非真实含有量;如未规定上限时,系指不超过101.0%。
制剂的含量限度范围,系根据该药味或主药含量的多少、测定方法误差、生产过程不可避免偏差和贮存期间可能产生降解的可接受程度而制定的,生产中应按标示量100%投料。如已知某一成分在生产或贮存期间含量会降低,生产时可适当增加投料量,以保证在有效期内含量能符合规定。
标准物质
二十七、品种正文中标准品、对照品、对照药材、对照提取物和参考品系指用于鉴别、检查、含量测定或效价测定等的标准物质。除另有规定外,均应为国家药品标准物质。标准物质的研制与管理应符合国家药品标准物质通则(通则0291)和国家药
品标准物质研制指导原则(指导原则9901)以及生物制品国家标准物质研制的有关要求。
标准物质的首批和换批研制,应与国际标准物质或原批号标准物质进行对比,然后按照国家药品标准物质相应的工作程序进行技术审定,确认其质量能够满足既定用途后方可使用。
标准物质均应附有使用说明书,其内容一般应包括名称、批号、特性或量值、用途、使用方法、贮藏条件和装量等信息。
标准物质均应按其标签或使用说明书所示的内容使用和贮藏。
计量
二十八、试验用的计量仪器均应符合国家相关规定。
二十九、本版药典采用的计量单位
(1)法定计量单位名称和单位符号如下:
长度米(m)分米(dm)厘米(cm)毫米(mm)微
米(μm)纳米(nm)
体积升(L)毫升(ml)微升(μl)
质(重)量千克(kg)克(g)毫克(mg)微克(μg)
纳克(ng)皮克(pg)
物质的量摩尔(mol)毫摩尔(mmol)
压力兆帕(MPa)千帕(kPa)帕(Pa)
温度摄氏度(℃)
动力黏度帕秒(Pa・s)毫帕秒(mPa•s)
运动黏度平方米每秒(m2/s)平方毫米每秒(mm2/s)
波数厘米的倒数(cm-1)
密度千克每立方米(kg/m3)克每立方厘米(g/cm3)
放射性活度吉贝可(GBq)兆贝可(MBq)千贝可(kBq)贝可(Bq)
(2)本版药典使用的滴定液和试液的浓度,以mol/L(摩尔/升)表示者,其浓度要求精密标定的滴定液用“XXX滴定液(YYYmol/L)”表示;作其他用途不需精密标定其浓度时,用“YYYmol/LXXX溶液”表示,以示区别。
(3)有关的温度描述,一般以下列名词术语表示:
水浴除另有规定外,系指98~100℃;
热水系指70~80℃;
微温或温水系指40~50℃;
室温(常温)系指10~30℃;
冷水系指2~10℃;
冰浴系指约0℃;
放冷系指放冷至室温。
(4)符号“%”表示百分比,系指重量的比例;但溶液的百分比,除另有规定外,系指溶液100ml中含有溶质若干克;乙醇的百分比,系指在20℃时容量的比例。此外,根据需要可采用下列符号:
%(g/g)表示溶液100g中含有溶质若干克;
%(ml/ml)表示溶液100ml中含有溶质若干毫升;
%(ml/g)表示溶液100g中含有溶质若干毫升;
%(g/ml)表示溶液100ml中含有溶质若干克。
(5)缩写“ppm”表示百万分比,系指重量或体积的比例,在核磁共振波谱中,“ppm”表示化学位移。
(6)缩写“ppb”表示十亿分比,系指重量或体积的比例。
(7)液体的滴,系在20℃时,以1.0ml水为20滴进行换算。
(8)溶液后标示的“(1→10)”等符号,系指固体溶质1.0g或液体溶质1.0ml加溶剂使成10ml的溶液;未指明用何种溶剂时,均系指水溶液;两种或两种以上液体的混合物,名称间用半字线“-”隔开,其后括号内所示的“:”符号,系指各液体混合时的体积(重量)比例。
(9)本版药典所用药筛,选用国家标准的R40/3系列,分等如下: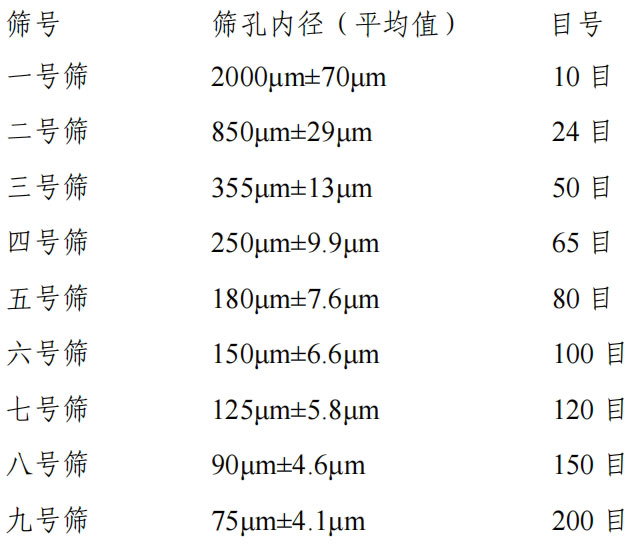
粉末分等如下:
最粗粉指能全部通过一号筛,但混有能通过三号筛不超过20%的粉末;
粗粉指能全部通过二号筛,但混有能通过四号筛不超过40%的粉末;
中粉指能全部通过四号筛,但混有能通过五号筛不超过60%的粉末;
细粉指能全部通过五号筛,并含能通过六号筛不少于95%的粉末;
最细粉指能全部通过六号筛,并含能通过七号筛不少于95%的粉末;
极细粉指能全部通过八号筛,并含能通过九号筛不少于95%的粉末。
(10)乙醇未指明浓度时,均系指95%(ml/ml)的乙醇。
三十、计算分子量以及换算因子等使用的原子量均按最新国际原子量表推荐的原子量。
精确度
三十一、本版药典规定取样量的准确度和试验精密度。
(1)试验中供试品与试药等“称重”或“量取”的量,均以阿拉伯数码表示,其精确度可根据数值的有效数位来确定,如称取“0.1g”,系指称取重量可为0.06~0.14g;称取“2g”,系指称取重量可为1.5~2.5g;称取“2.0g”,系指称取重量可为1.95~2.05g;称取“2.00g”,系指称取重量可为1.995~2.005g。
“精密称定”系指称取重量应准确至所取重量的千分之一;
“称定”系指称取重量应准确至所取重量的百分之一;
“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精密度要求;
“量取”系指可用量筒或按照量取体积的有效数位选用量具。
取用量为“约”若干时,系指取用量不得超过规定量的±10%。
(2)恒重,除另有规定外,系指供试品连续两次干燥或炽灼后称重的差异在0.3mg以下的重量;干燥至恒重的第二次及以后各次称重均应在规定条件下继续干燥1小时后进行;炽灼至恒重的第二次称重应在继续炽灼30分钟后进行。
(3)试验中规定“按干燥品(或无水物,或无溶剂)计算”时,除另有规定外,应取未经干燥(或未去水,或未去溶剂)的供试品进行试验,并将计算中的取用量按检查项下测得的干燥失重(或水分,或溶剂)扣除。
如不进行干燥失重测定,而仅对残留溶剂进行定量测定时,上述计算应考虑扣除残留溶剂的量。
(4)试验中的“空白试验”,系指在不加供试品或以等量溶剂替代供试液的情况下,按同法操作所得的结果;含量测定中的“并将滴定的结果用空白试验校正”,系指按供试品所耗滴定液的量(ml)与空白试验中所耗滴定液的量(ml)之差进行计算。
(5)试验时的温度,未注明者,系指在室温下进行;温度高低对试验结果有显著影响者,除另有规定外,应以25℃±2℃为准。
(6)品种正文或通用技术要求中如出现容器、色谱柱等材料或仪器的规格或型号,仅作为推荐。
试药、试液、指示剂
三十二、试验用的试药,除另有规定外,均应根据通则试药项下的规定,选用不同等级并符合国家标准或国务院有关行政主管部门规定的试剂标准。试液、缓冲液、指示剂与指示液、滴定液等,均应符合通则的规定或按照通则的规定制备。
三十三、试验用水,除另有规定外,均系指纯化水。酸碱度检查所用的水,均系指新沸并放冷至室温的水。
三十四、酸碱性试验时,如未指明用何种指示剂,均系指石蕊试纸。
动物试验
三十五、动物试验所使用的动物应为健康动物,其管理应符合国家相关规定。
动物品系、年龄、性别、体重和微生物等应符合药品检定要求。
三十六、凡是有准确的理化分析方法或体外生物学方法能取代动物试验进行药品质量检测或检定,应尽量采用,以减少动物试验。
说明书、包装与标签
三十七、药品说明书应符合《中华人民共和国药品管理法》及国务院药品监督管理部门对说明书的规定。
三十八、直接接触药品的包装材料和容器应符合国务院药品监督管理部门的有关规定,均应无毒、洁净,与内容药品应不发生化学反应,并不得影响内容药品的质量。
三十九、药品标签应符合《中华人民共和国药品管理法》及国务院药品监督管理部门对包装标签的规定,不同包装标签其内容应根据上述规定印制,并应尽可能多地包含药品信息。
四十、麻醉药品、精神药品、医疗用毒性药品、放射性药品、外用药品和非处方药品的说明书和包装标签,必须印有规定的标识。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。