24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
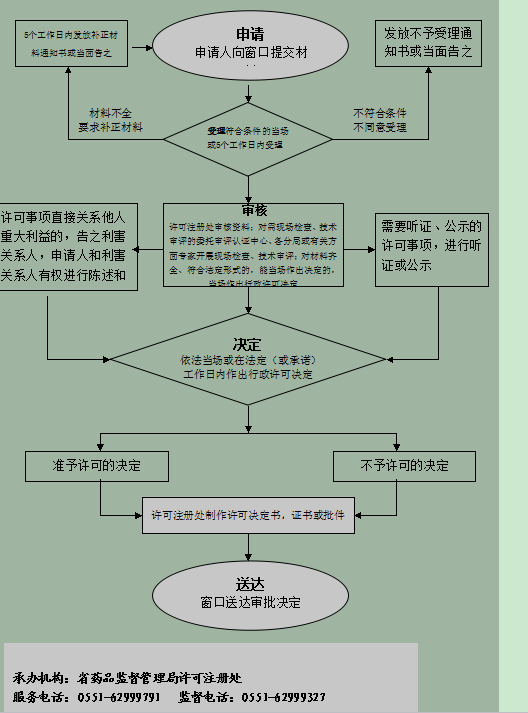
想要在安徽省合法销售第二类医疗器械,必须完成产品注册审批。很多企业对这个流程感到陌生,甚至因为准备不足导致申请失败。本文将用最直白的方式拆解整个流程,手把手教你如何高效完成注册。
第一步:确认产品分类和资质条件
医疗器械分为三类,第二类是指需要严格控制管理以保证安全有效的品种,比如血压计、体温计等。安徽省内的企业要申请这类产品注册,首先要确认产品确实属于二类目录。登录国家药监局官网或咨询省药监局确认分类,这一步千万不能错,分类错误直接导致申请被拒。
企业自身需要具备:营业执照、生产许可证(已建立符合《医疗器械生产质量管理规范》的体系)、产品技术团队。如果是初创企业,建议先到省药监局参加培训,了解质量管理体系的具体要求,避免后期反复整改。
第二步:准备核心申报材料
所有材料需在线提交至安徽政务服务网,分为六大模块:
| 材料模块 | 关键内容 | 准备要点 |
|---|---|---|
| 监管信息 | 注册申请表、关联文件(如委托协议) | 表格需逐项填写,委托生产需提供双方盖章协议 |
| 综述资料 | 产品描述、适用范围、工作原理、型号规格 | 用图文结合方式说明产品结构,避免使用模糊描述 |
| 非临床资料 | 产品技术要求、检验报告、生物学评价 | 检测机构需具备CMA资质,报告有效期6个月内 |
| 临床评价资料 | 临床试验报告/同品种比对数据 | 符合豁免目录的产品可免临床(文末附常见豁免类型) |
| 说明书标签 | 中文版说明书样稿、最小销售单元标签设计 | 需标注“皖械注准”字样,禁忌症和注意事项必须突出显示 |
| 质量体系文件 | 生产场地证明、工艺流程图、关键工序记录、内审报告 | 重点体现原材料管控和灭菌过程(如有) |
临床数据特别说明:
根据2023年最新政策,以下情况可豁免临床试验(具体以《免于临床评价医疗器械目录》为准):
| 豁免类型 | 示例产品 | 替代方案 |
|---|---|---|
| 同品种已上市 | 电子体温计(已有10个同类证) | 提供对比数据及差异说明 |
| 列入豁免目录 | 医用防护口罩 | 提交符合国标的检测报告 |
| 通过实验室验证 | 部分体外诊断试剂 | 提交分析性能评估资料 |
第三步:线上提交与进度跟踪
1.注册账号:进入安徽政务服务网(https://www.ahzwfw.gov.cn),完成法人账号实名认证。
2.填报信息:在“企业办事”栏目选择“第二类医疗器械产品首次注册”,逐项上传PDF格式材料(单个文件不超过50M)。
3.缴费环节:提交后3个工作日内会收到缴费通知,目前注册费为93900元/品种,可通过网银支付。(截止26年1月1日,费用降到45045元)
常见卡点解决:
材料被退回:通常因漏盖章或骑缝章不全,所有纸质材料扫描件需加盖公章(包括每页右下角)。
技术审评延长:若审评中心要求补充资料,需在60日内重新提交,否则视为放弃申请。
第四步:现场审查与取证
虽然政策允许全程网办,但部分高风险产品(如植入类器械)可能被抽中现场核查。核查重点包括:
生产车间与申报材料是否一致
关键岗位人员能否熟练操作设备
留样产品与送检样品的一致性
通过审批后,可选择在省政务中心(合肥市包河区)窗口自取注册证,或申请免费邮寄。下证后需在30日内到“国家药监局数据查询平台”完成信息公示。
特别提醒:避免三大高频失误
1.临床评价踩雷:非豁免产品若选择同品种比对,必须取得原厂授权,否则视为无效。
2.型号覆盖错误:同一注册证下的不同型号需在“产品技术要求”中明确差异,例如血糖仪的测量范围差异超过±15%需单独申报。
3.体系文件造假:2022年有企业因伪造生产记录被列入黑名单,体系审核现已接入“安徽省药监智慧云平台”实时调取数据。
(注:本文参考《医疗器械监督管理条例》《医疗器械注册与备案管理办法》等法规,具体执行以药监部门最新通知为准)
通过这四步分解,相信您对注册流程已经有了清晰认知。建议提前3-6个月启动准备工作,遇到疑难问题可以联系飞速度CRO之类的专业CRO公司,工作人员会给予详细指导。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。