24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
医疗器械的安全性和有效性直接关系到公众健康,规范注册流程是保障产品质量的重要环节。江苏省作为医疗器械产业聚集地,企业数量庞大,每年有大量产品需要完成上市前审批。第二类医疗器械属于中风险类别,常见产品包括血压计、体温计、隐形眼镜护理液等,注册过程需经过材料准备、技术审评、体系核查等多个环节。本文将以通俗易懂的方式,为首次办理注册的企业梳理具体操作流程。
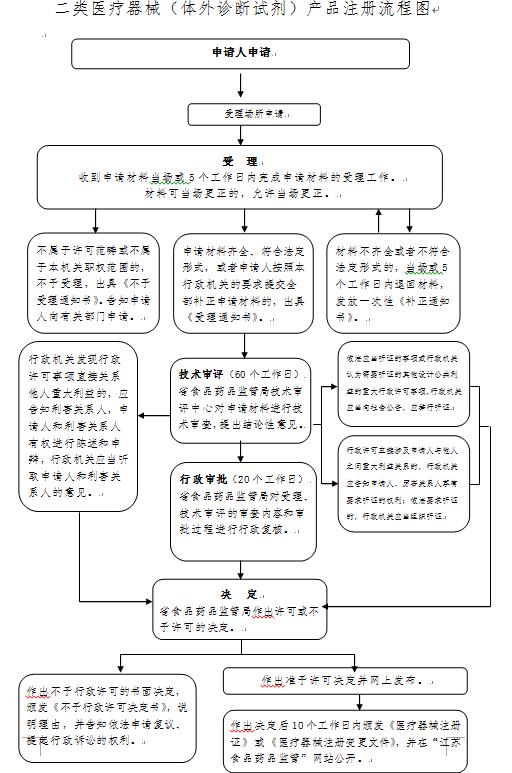
第一步 准备注册申请材料
注册材料包含7大类51项文件,核心材料包括营业执照副本、产品技术要求、检验报告、临床评价资料等。其中营业执照需加盖公章,注册地址必须与生产地址一致。若委托其他企业生产,需额外提交委托协议和受托方生产资质证明。
材料中需特别注意产品技术要求的编写,应参照《医疗器械产品技术要求编写指导原则》,明确性能指标、检测方法等内容。临床评价资料根据产品风险程度分为两种路径:需开展临床试验的需提交完整试验报告;符合免临床目录的产品可通过同品种对比数据完成评价。2023年江苏省药监局统计显示,约68%的二类器械通过同品种对比路径完成临床评价。
第二步 在线提交申请
登录江苏政务服务网(http://www.jszwfw.gov.cn),进入“省级药品监管”专区选择第二类医疗器械注册事项。系统支持PDF格式文件上传,单个文件不超过50M。填写申请表时需准确选择产品分类编码,错误编码会导致申请退回。
提交后5个工作日内会收到受理通知。常见补正问题包括:未提交检验机构资质证明、产品命名不符合《医疗器械通用名称命名规则》、未提供灭菌验证报告等。2022年受理退回案例中,25%因材料缺失导致。
第三步 技术审评与现场核查
技术审评阶段重点关注产品安全有效性,平均耗时40个工作日。审评人员会核对产品检测报告与技术要求的一致性,评估生物学评价、灭菌验证等关键数据。临床数据需符合《医疗器械临床评价技术指导原则》,临床试验报告应包含受试者入选标准、不良事件记录等核心要素。
同步开展的体系核查采用“线上+线下”模式,核查组通过远程调阅生产记录、现场检查设备验证情况等方式,确认企业符合《医疗器械生产质量管理规范》。2023年体系核查通过率为89%,常见问题集中在原材料采购控制和生产环境监测环节。
第四步 缴纳注册费用
通过初审后需缴纳59,150元注册费。小微企业凭工信部认定证明可享受全额减免,2023年江苏省共有132家企业享受该政策。缴费凭证需上传至申报系统,缴费后5个工作日内进入行政审批环节。
第五步 领取注册证书
审批通过后,企业可在线下载电子注册证或至南京市建邺区政务服务中心领取纸质证书。注册证载明产品型号规格、有效期等信息,需注意五年有效期内需办理延续注册。证书信息同步录入国家药监局数据库,产品可正式上市销售。
(临床评价路径对照表)
| 评价类型 | 适用条件 | 所需材料 | 平均耗时 |
|---|---|---|---|
| 同品种对比 | 列入免临床目录产品 | 对比器械注册证、对比数据表 | 20工作日 |
| 临床试验 | 新型产品/高风险产品 | 伦理批件、完整试验报告 | 6-12个月 |
整个注册流程约需60个工作日,企业可通过政务服务网实时查询进度。建议提前三个月准备材料,重点关注临床评价方案设计和生产体系合规性。注册过程中保持与审评人员的沟通,及时补充说明性文件可有效缩短办理时间。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。