24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
制备医用臭氧治疗妇科疾病的医用臭氧妇科治疗仪在我国属于有源第二类医疗器械注册,分类编码为18妇产科、辅助生殖和避孕器械-04 妇产科治疗器械-01妇科物理治疗器械。但是产品不在免于医疗器械临床试验目录内,医疗器械注册人需要通过同品种临床评价或是医疗器械临床试验完成医疗器械临床评价。本文为大家介绍医用臭氧妇科治疗仪产品技术要求及医疗器械注册要点,一起看正文。

一、医用臭氧妇科治疗仪注册单元划分的原则和实例
医用臭氧妇科治疗仪注册单元划分需符合《医疗器械注册单元划分指导原则》的要求,医用臭氧妇科治疗仪的注册单元原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
采用电晕法、电解法或其他不同技术原理的产品需划分为不同单元。
同一企业生产采用相同的电源部分、臭氧发生器等结构的产品,产生的臭氧浓度一样,且适用范围相同,存在臭氧气、臭氧水冲洗、臭氧雾三种或两种功能合一的型号可以与简化上述结构只存在其中两种或者一种功能的型号产品归入同一注册单元。
实例:存在臭氧气、臭氧水冲洗、臭氧雾三种功能合一的型号D仪器,可以与只存在臭氧气功能型号A仪器,只存在臭氧水功能型号B仪器,只存在臭氧雾功能型号C仪器,以及涵盖上述两种功能的仪器合并申报。
二、医用臭氧妇科治疗仪产品工作原理和作用机理
2.1工作原理
目前,医用臭氧妇科治疗仪有臭氧水、臭氧雾和臭氧气三种输出形式。其中,臭氧制备方法有电晕放电法、电解法、化学法、紫外线法、辐照法。目前,医用臭氧妇科治疗仪大多数采用电晕放电法制取臭氧,少数采用电解法。
电晕法制取臭氧的过程为:干燥的空(氧)气流过高频电场管式电极,利用高速高能电子轰击氧气分子,使其分解成氧原子。高速高能电子具有足够的能量(6—7ev),紧接着通过三体(O、O2和M)碰撞反应形成臭氧。与此同时,原子氧和电子也同样与臭氧反应分解为氧气。其反应方程如下:
① e+O2 →2O+e
② O+O2 +M→O3+M
③ O+O3 →2O2
④ e+O3 →O+O2 +e
(注:e:高速高能电子;M:气体中其他任何气体分子)
臭氧在水溶液中存在下列链式反应:
O3+H2O→HO3++OH-
HO3++OH-→2HO2
O3+HO2→HO+2O2
HO2+HO→H2O+O2
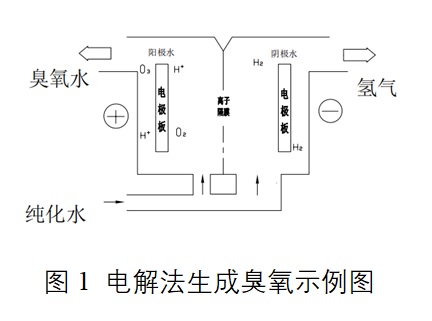
电解水制取臭氧的过程为:以纯化水(去离子水)为原料,利用隔膜式电解槽,在阳极和阴极之间施加低压直流电流进行电解,在阳极侧生成臭氧,在阴极侧生成氢气。
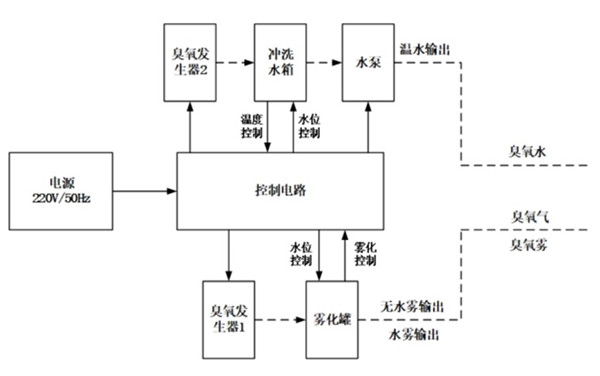
臭氧雾是将臭氧和雾化罐产生的水雾进行混合,利用雾作为载体,使臭氧到达病灶部位。
申请人需说明臭氧的制备原理、提供产品的水、气通路图,说明生成臭氧水、臭氧气、臭氧雾的具体过程。
说明:细实线表示电气控制,虚线表示水、气通路
2.2作用机理
臭氧是氧的同素异形体,在常温下分子极不稳定,可分解产生单原子氧(O),在水中与水分子结合产生羟基(-OH)。单原子氧(O)和羟基(-OH)具有极强的氧化能力,可氧化分解细菌、病毒内部的葡萄糖氧化酶,直接与细菌、霉菌、病毒等微生物发生作用,细菌、霉菌、病毒等微生物在一定浓度的臭氧水中无法生存。
外阴阴道假丝酵母菌病、滴虫性阴道炎、细菌性阴道病等多种妇科病是妇科临床治疗的主要研究方向。医用臭氧妇科治疗仪应用仪器制备的臭氧水(气、雾)冲洗(进入)阴道,使气态臭氧或臭氧水中的羟基(-OH)渗透至病变深层处,杀灭与清除阴道内致病菌和病原微生物;同时臭氧还原后形成的高浓度氧环境,改变阴道内的厌氧环境,使阴道内加德纳嗜血性厌氧菌和其他厌氧菌不适应在有氧环境中生长,有助于溃疡、创面的快速愈合,有利于阴道内正常菌群重建,达到治疗目的。
三、医用臭氧妇科治疗仪产品技术要求
产品技术要求可参照《医疗器械产品技术要求编写指导原则》等规范性文件进行编制,目前尚无医用臭氧妇科治疗仪的行业标准实施,所以本指导原则针对部分性能指标提供了可参考的要求,考虑到不同申报产品之间的差异,未规定限值,申请人需结合自身产品特点进行量化。在性能指标中需明确产品的全部临床应用的功能。以下列出可能的产品功能、性能,示例是一种举例,申请人根据产品的实际情况进一步完善产品的功能、性能。
3.1产品型号规格及其划分说明
产品可按结构组成、技术参数、预期用途等划分为不同型号和规格。
若产品有多个型号,需提供型号间的主要差异对比表。
说明软件组件名称、型号规格(若适用)、软件发布版本、软件完整版本命名规则,明确软件完整版本的全部字段,逐项说明每字段含义等。
申请人需列明治疗头材料信息。
3.2性能指标
3.2.1利用臭氧水进行治疗的仪器需有以下要求:
①出水压力;
②出水流量;
③臭氧水浓度;
④具有水温控制的仪器需有温度控制范围及精度要求;
⑤超温保护。
3.2.2利用臭氧气进行治疗的仪器需有以下要求:
①臭氧气流量;
②臭氧气浓度;
③臭氧气体泄漏;
3.2.3具有雾化功能的仪器需至少有雾化率要求。
3.2.4治疗头要求,如长度、圆头直径、一次性使用无菌治疗头,需至少规定无菌要求,采用环氧乙烷灭菌的,还需规定环氧乙烷残留量的要求。
治疗头如为外购产品,需购买已取得医疗器械注册证的产品。
3.2.5外观和结构要求
①仪器表面应光洁、色泽均匀、无伤斑、划痕、裂纹等缺陷,面板上文字和标志应清晰;
②控制和调节机构应灵活、可靠,紧固部位应无松动;
③塑料件及治疗手柄、治疗头等附件应光滑,无明显斑痕、毛刺、划痕、凹陷、起泡、开裂、变形现象,金属件不应有锈蚀及机械损伤。
3.2.6需符合《医疗器械软件注册审查指导原则》(2022修订版)《医疗器械网络安全注册审查指导原则》(2022年修订版)的要求:如制定压力、流量和(或)浓度调节、定时、臭氧水加热和恒温、臭氧水冲洗、臭氧雾化、臭氧气治疗、提示等软件的临床功能纲要、以及使用限制、接口、访问控制、运行环境(若适用)、性能效率(若适用)等要求,且需与说明书中的功能描述一致。
3.2.7噪声要求。
3.2.8安全性能
电气安全需符合GB 9706.1的要求。
电磁兼容需符合YY 9706.102的要求。
产品若具有其他特定功能,需制定相应要求。若含有脚踏开关需符合YY/T 1057。
产品各项参数范围的设置需保证治疗的安全性和有效性。
如有医用臭氧妇科治疗仪产品技术要求或是医疗器械注册咨询服务需求,欢迎您随时方便与北京飞速度医疗科技有限公司联络,联系人:施先生,电话:19103801095,微信同。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。