24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
对于上海市第二类医疗器械注册产品来说,多数产品可以通过免于医疗器械临床试验临床评价或是医疗器械同品种比对临床评价方式,本文为大家带来上海市第二类有源医疗器械注册临床评价资料常见问题,一起看正文。
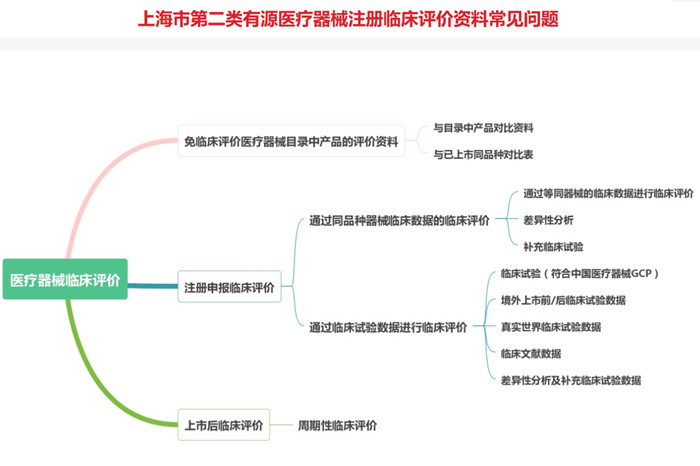
上海市第二类有源医疗器械注册临床评价资料常见问题
(1)免临床评价目录内产品:
①申报产品与《免于进行临床试验的医疗器械目录》产品描述有差异;
②未按照《免于进行临床试验的医疗器械目录》规范适用范围;
③与境内已注册产品的对比不全面,未考虑主要性能指标、软件功能等方面差异,或差异较大,不能证明两者具有基本等同性。
例如:医学影像传输及存储软件产品实际包含三维重建等图像处理功能、远程会诊功能,与目录21-02-01差异较大,需判断合适的分类编码,需判断相关功能是否全部属于免临床目录范畴;皮肤影像工作站产品的结构组成、适用范围与免临床目录06-18-01内容差异较大,企业需提供产品属于免临床目录的充足理由;荧光免疫层析分析仪产品申报资料未见申报产品与对比产品在工作原理、荧光标记物、激发光谱、检测项目等方面的异同,请提供详细的性能指标、软件功能等对比资料,对存在的差异进行详细分析判断,并提供充分的支持性资料;皮肤影像工作站产品比对产品采用荧光检查灯,且软件功能与申报产品差异较大,需对差异性进行充分以证明两者具备等同性。
(2)通过医疗器械同品种比对临床评价路径开展评价:
上海市第二类有源医疗器械注册人提交的临床资料缺少同品种产品的临床数据资料,未说明两者相关性,例如4K三维电子胸腹腔镜产品请提交同品种产品的临床数据资料或者目前临床数据为同品种产品的依据,且为中文。
如有上海市第二类有源医疗器械注册咨询或是医疗器械同品种比对临床评价服务需求,欢迎您随时方便与北京飞速度医疗科技有限公司联络,联系人:施先生,电话:19103801095,微信同。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。