24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
在医疗机构中使用,通过对人体组织的汽化、碳化、凝固和照射达到治疗的目的的,用于(具体部位)的手术/预期用于(具体皮肤病症)治疗的二氧化碳激光治疗设备在我国属于第三类医疗器械注册产品。近日,国家药监局发布《二氧化碳激光治疗设备注册审查指导原则(征求意见稿)》,借这个契机,写个文章为大家说说二氧化碳激光治疗设备注册要点及产品技术要求。
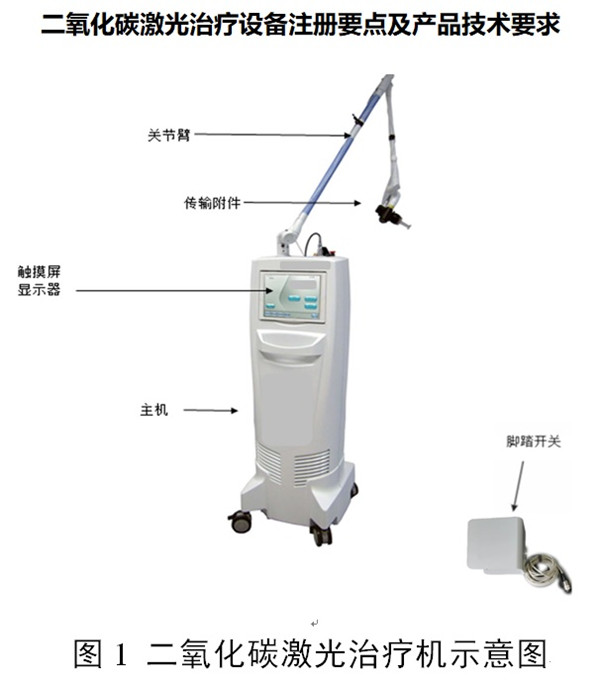
一、二氧化碳激光治疗设备注册产品的工作原理及作用原理
二氧化碳激光治疗设备通常由二氧化碳激光器、电源和控制系统、安全防护系统、瞄准传输系统、冷却系统和输出系统及附件(可包括输出手具、扫描装置/点阵输出装置、脚踏开关、护目镜等)组成。按照现行《医疗器械分类目录》,此类产品分类编码为:01-02-01或09-03-01,管理类别为Ⅲ类。按照临床用途,用于手术室外科手术的二氧化碳激光手术设备分类为:01-02-01,用于皮肤科、整形科的二氧化碳激光治疗设备分类为:09-03-01。二氧化碳激光治疗设备通常属于强激光。
1.1工作原理
二氧化碳(CO2)激光器是以CO2气体分子作为工作物质的气体激光器。可输出激光波长为10.6μm或9.6μm,常见波长为10.6μm。二氧化碳激光器的工作物质除了CO2气体外,还有适量的辅助气体氮气(N2)和氦气(He)等。
二氧化碳分子经电压激发后从低能级跃迁到高能级上形成粒子束反转发出激光能量,二氧化碳激光的能级跃迁可分别发射10.6μm或9.6μm的激光,10.6μm和9.6μm两条谱线有共同的激光上能级,因此它们之间产生强烈的谱线竞争,由于10.6μm波长的跃迁几率比9.6μm的大,所以通常CO2激光器的输出激光波长为10.6μm。
典型的封离式CO2激光器结构包括腔片、放电管、电极和电源等几部分。二氧化碳激光管通常由硬质玻璃制成,采用套筒式结构,最里面一层是放电管,第二层为水冷套管,最外层为储气管。谐振腔通常由全反射镜和部分反射镜组成,主要作用是控制光束的传播方向,提高单色性,选定输出模式和增长激活介质的工作长度。泵浦源提供能量使工作物质中上下能级间的粒子数反转。
申报产品的综述资料中应说明CO2激光器的类型,特别是如果采用非典型的封离式激光器,应明确其具体类型及设计依据。
1.1.2作用原理
激光与人体组织的相互作用机理通常可分为热效应、光化效应、光致爆破效应和生物刺激效应。二氧化碳激光治疗设备主要是激光对组织的热效应。热效应是指CO2激光的能量能有效地被组织中的水分吸收,组织吸收激光能量后转化为热能,导致组织温度升高。根据组织的不同反应,通常可以实现对人体组织的汽化、碳化、凝固以达到治疗的目的。
申报资料的综述资料中,应说明申报产品的具体作用机理,预期作用的靶组织类型和预期的作用效果。
二、二氧化碳激光治疗设备产品技术要求及主要性能指标
医疗器械注册申请人应按照《医疗器械产品技术要求编写指导原则》编写产品技术要求。建议注册申请人参考对应的国家标准GB/T 11748,并根据自身产品的技术特点制定产品技术要求中的性能指标和测试方法。
产品技术要求应明确产品型号规格及划分说明。需注明软件发布版本、软件版本号命名规则,其中软件版本命名规则需与软件研究资料保持一致。
对于性能指标的制定,根据产品自身性能,应至少包括激光波长、激光模式、激光输出方式及其时间特性、激光脉冲(串)终端输出能量/功率、激光终端输出功率/能量的不稳定度、激光终端输出功率/能量的复现性、激光光斑尺寸、瞄准光波长和功率、冷却方式(设备冷却和或接触部分冷却)、激光防护镜防护参数、光纤参数(如适用)、点阵输出参数(如有)、点阵图形等。
应注意,若以重复脉冲串的方式输出,除了子脉冲宽度和间隔,还应有脉冲串宽度和脉冲串间隔要求。二氧化碳激光治疗设备如果采用调制技术获得窄脉冲高峰值功率的激光,应说明调制方式,给出实际的波形图示及峰值功率。
需生产企业灭菌提供的附件应确保无菌(可参考GB/T 14233.2《医用输液、输血、注射器具检验方法 第2部分:生物学试验方法》的试验方法)。对于采用环氧乙烷灭菌的产品,应制定环氧乙烷残留量要求(可参考GB/T 16886.7《医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量》)。
如产品组成中有脚踏开关,应符合YY/T 1057的要求。
如果组成中包含医用激光光纤,相关要求应参照《医用激光光纤注册技术审查指导原则》,并应符合YY/T 0758的要求。
如涉及网络安全,应按照《医疗器械网络安全注册审查指导原则》,给出产品技术要求中应包含的性能要求和需载明的信息。
对于试验方法,产品性能指标的试验方法如依照国标/行标制定,应与国标/行标一致,如申请人自定或者采用国标方法但不完全一致,应在研究资料中的性能研究部分说明自定义指标和方法的科学、合理性依据。另外,所有配用附件(包括聚焦手具、点阵/扫描手具、显微镜组件、套筒等)都应分别安装到设备上进行测试。如选择典型性型号测试,应有覆盖性依据。
产品技术要求附录中应有电气安全特征和产品外观(结构)图示。
三、二氧化碳激光治疗设备注册注意事项
医疗器械注册人需要特别关注的情况包括:
(1)按照临床功能(对应手具)分别制定技术指标
二氧化碳激光治疗设备具有多个临床应用模式的情况下,通常在主机显示界面会对应不同的用户操作界面,同时在配用相应的手具时,软件激活对应的操作界面,完成相应的临床用途。在制定产品技术要求的性能指标时,应按照每种用户可操作界面,在配用对应的手具下,给出对应的各项激光输出具体参数。
(2)关于不同技术参数指标之间的关系
当脉冲输出时,脉冲能量/功率、平均功率、脉宽和频率等参数需明确开放给用户调节的是哪个或者哪些参数,其他随之调节的参数,与可调节参数之间的换算关系需要说明。在产品技术要求中,上述涉及的主要参数均需列入指标要求,具体试验方法可参照标准规定方法开展。
具体可调节哪些参数,或者在用户界面显示哪些参数,由制造商规定。
如有二氧化碳激光治疗设备注册咨询、第三类医疗器械注册咨询、医疗器械产品技术要求编制服务需求,欢迎您随时方便与北京飞速度医疗科技有限公司联络,联系人:施先生,电话:19103801095,微信同。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。