24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

2019年9月19日,据国家医保局官网消息,医保局发布了《关于政协十三届全国委员会第二次会议第0537号提案答复的函》。针对关于理顺医疗服务项目比价关系、推动医疗服务项目制定等问题,进行了答复。
查看详情
如果你是初入医疗器械或者是想踏入医疗器械行业从事注册工作的,那今天介绍的网站内容就可以帮助你找到方向。国内医疗器械注册小白常用的网站如下:
查看详情
规范医疗器械制造商提供的信息(包括医疗器械的标签、标识和提供信息的符号等标记),有利于消除医疗器械国际贸易技术壁垒、降低成本;在医疗器械标记中提供必要的安全信息,则有利于提高医疗器械使用的安全性和可追溯性。
查看详情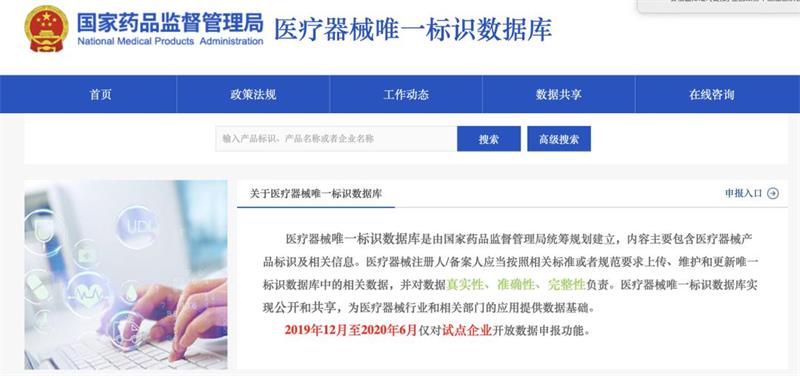
医疗器械唯一标识(UDI)贯通医疗器械生产经营使用各环节,能确保医疗器械生产和使用安全,是医疗器械非常有用的身!份!信!息!作为医疗器械的身份证,有需要的小伙伴怎么可以一键查询呢?看这里↓手把手教你一键查询UDI。
查看详情
2014年2月9日,CFDA与卫计委联合发布了《关于加强临床使用基因测序相关产品和技术管理的通知》,通知明确规定基因测序诊断产品(包括基因测序仪及相关诊断试剂和软件),通过对人
查看详情
随着中国疫情得到缓解,而境外特别是欧盟疫情防控形势严峻,欧盟对口罩的需求上升,而作为口罩生产大国,口罩企业继“民转医”经历之后,将迅速转入“医转外”,“民转外”的过程。为了应广大口罩企业的需求,飞速度依据欧盟相关法规整理了口罩如何快速获得欧盟认证,一起来看看口罩出口欧盟认证流程指南。
查看详情
ISO13485认证标准中,很多术语和定义是需要大家细致、反复品味才能理解其内涵,后续,我尝试着从自身经历角度,为大家科普相关术语,希望有帮到大家。
查看详情
全生命周期管理在许多行业得到了广泛应用,药监监管领域,也需要企业对医疗器械注册证、医疗器械经营许可证等有效期的证件执行全生命周期主动管理。本文为您介绍郑州医疗器械经营许可证注销流程和要求。
查看详情