24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

一次性使用无菌拉钩由头部和柄部组成,头部带有不锈钢嵌入物,用于手术时钩拉组织或皮肤,暴露手术视野。基本信息 项目 内容 产品名称
查看详情
一次性使用透析护理包按基本配置组成不同分A、B、C三种型号,临床用于透析前后的护理操作用。 基本信息 项目 内容 产品名称
查看详情
本产品为细胞医学图像分析系统,规格型号包括NG-A1Pro、NG-A3Pro、NG-A5Pro。主要组成成分由仪器主机(含玻片托盘)、软件(软件名称:细胞医学图像分析软件,软件型号:NG-A5P
查看详情
毫米波治疗仪通过改善局部血液循环对软组织感染、伤口感染、静脉炎、无菌性炎症起到消炎、消肿、止痛、促进血液循环和组织生长恢复、伤口愈合的目的。基本信息
查看详情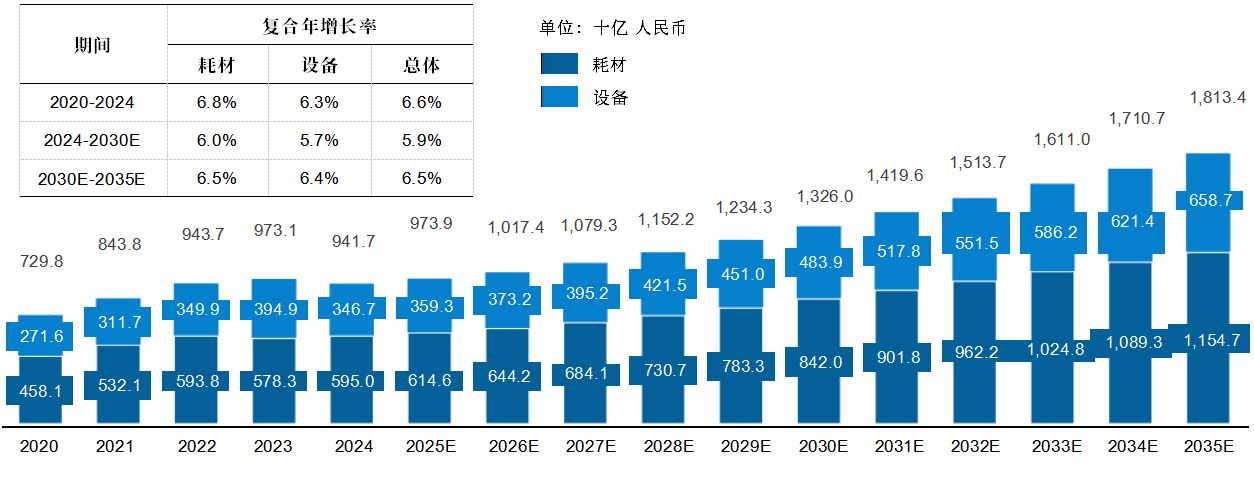
随着人口老龄化加速,医疗需求升级及技术创新等因素持续推动,中国及全球医疗器械市场正呈现稳步增长态势,并将在未来释放出更大的增长潜力全球及中国医疗器械市场规模 随
查看详情
2025年10月,河北省药品监督管理局共批准首次注册第二类医疗器械产品22个(详见附件)。 特此公告。 附件:2025年10月批准首次注册第二类医疗器械产品目录.pdf 河北
查看详情
本产品是十三种肺癌相关抗体检测试剂盒(流式荧光免疫法),属于第三类体外诊断试剂,由广州市丹蓝生物科技有限公司申请注册。产品用于体外检测人血清中13种肺癌相关抗体(识
查看详情
本产品是一次性使用压力监测心脏脉冲电场消融导管,属于第三类医疗器械,由上海微创电生理医疗科技股份有限公司申请注册。产品由导管和连接尾线(型号:EPBQ150A)组成,与心脏脉
查看详情