24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
第一章药品注册申请受理情况
(一)总体情况
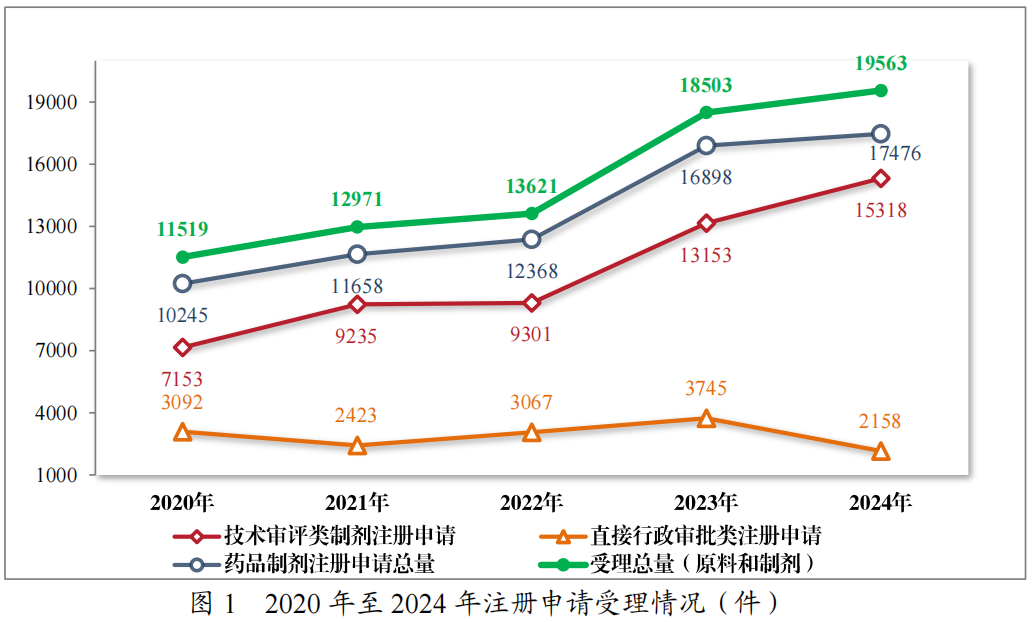
2024年,药品注册申请申报量持续增长,药审中心受理各类注册申请19563件(同比增加5.73%,以受理号计,下同),包括药品制剂注册申请17476件(同比增加3.42%),化学原料药注册申请2087件(同比增加30.03%)。17476件药品制剂注册申请包括技术审评类注册申请15318件(同比增加16.46%),直接行政审批类注册申请2158件(包括补充申请和一次性进口)。2020年至2024年注册申请受理情况详见图1。
(二)技术审评类药品注册申请受理情况
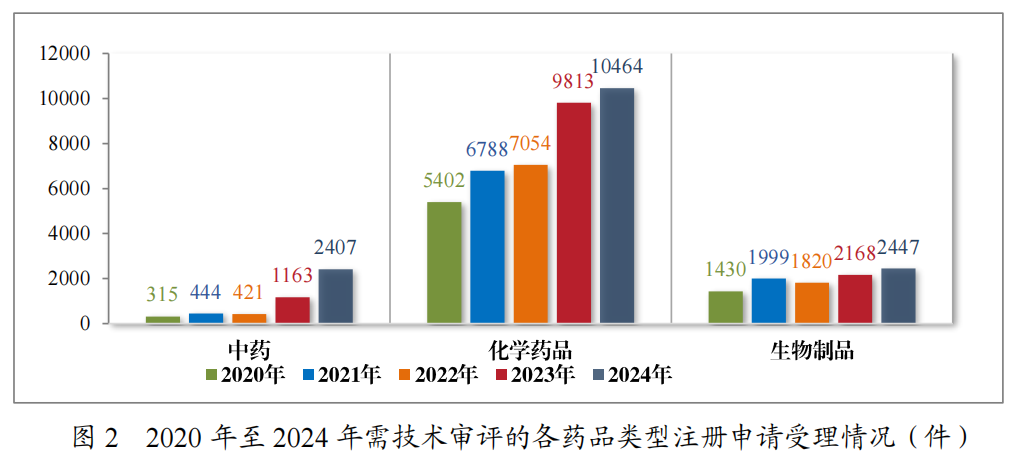
2024年受理的15318件技术审评类药品注册申请中,以药品类型统计,中药注册申请2407件,化学药品注册申请10464件,生物制品注册申请2447件。2020年至2024年需技术审评的各药品类型注册申请受理情况详见图2。
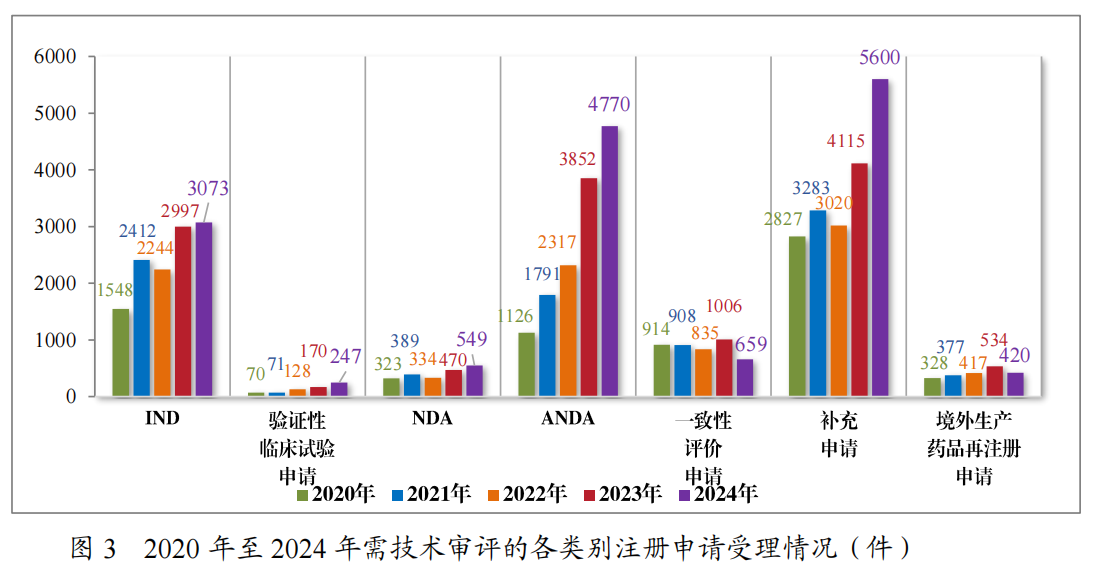
以注册申请类别统计,受理新药临床试验申请(该注册申请类别以下简称“IND”)3073件,验证性临床试验申请247件,新药上市许可申请(该注册申请类别以下简称“NDA”)549件,同名同方药、化学仿制药上市许可申请(该注册申请类别以下简称“ANDA”)4770件,仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称“一致性评价申请”)659件,补充申请5600件,境外生产药品再注册申请420件。2020年至2024年需技术审评的各类别注册申请受理情况详见图3。
1.中药注册申请受理情况
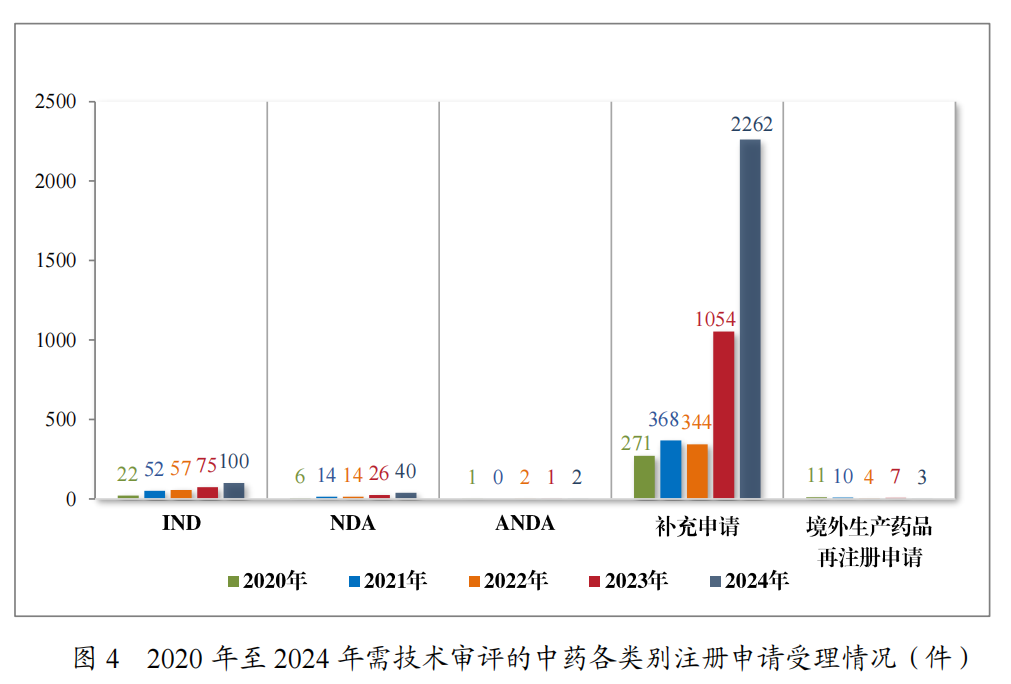
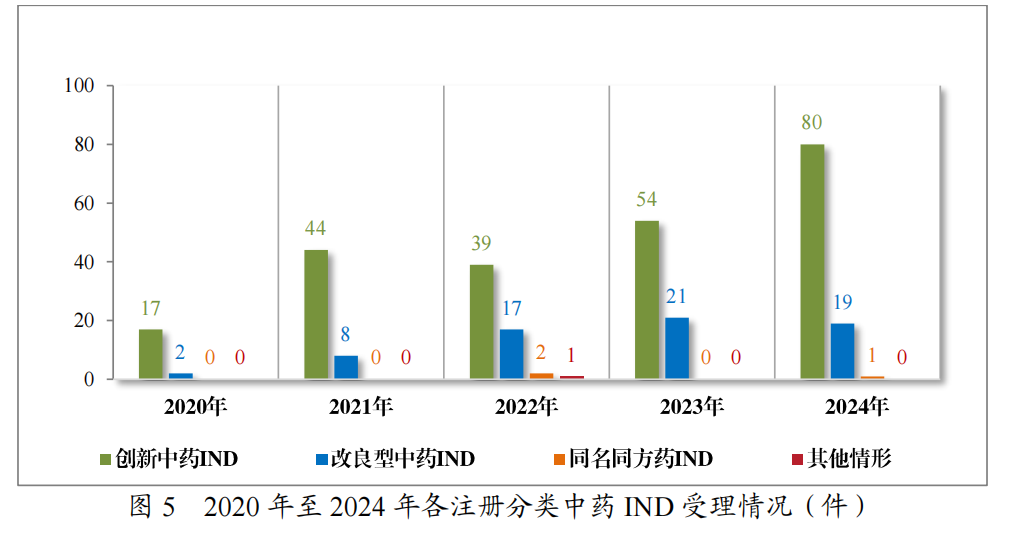
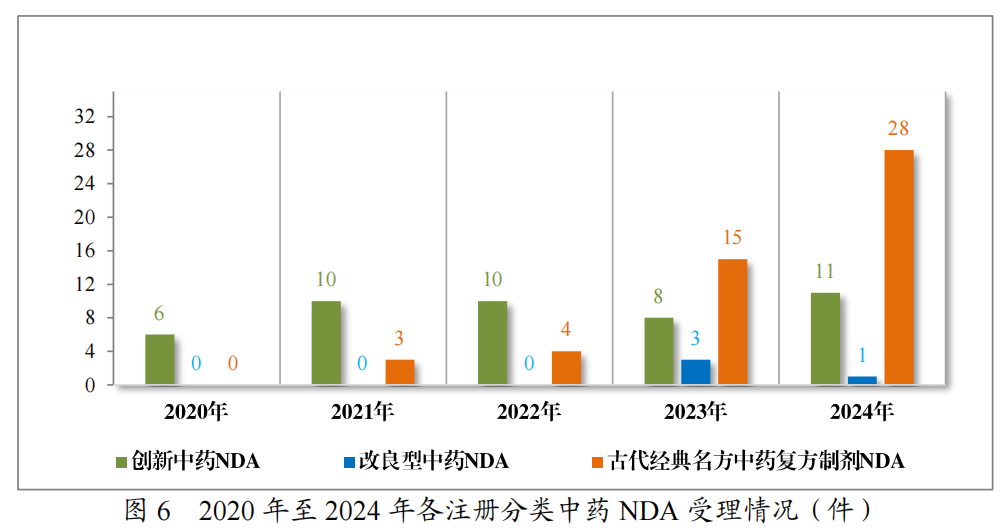
2024年受理中药注册申请2407件,按注册申请类别统计,IND100件,NDA40件,补充申请2262件,ANDA2件,境外生产药品再注册申请3件。2020年至2024年需技术审评的中药各类别注册申请受理情况详见图4。
以注册分类统计,100件IND中,包括创新中药IND80件(71个品种),改良型中药IND 19件(16个品种),同名同方药IND1件(1个品种);40件NDA中,包括创新中药NDA 11件(11个品种),改良型中药NDA 1件(1个品种),古代经典名方中药复方制剂NDA28件(17个品种)。
2024年各注册分类中药IND、NDA受理情况详见表1,2020年至2024年各注册分类中药IND受理情况详见图5,2020年至2024年各注册分类中药NDA受理情况详见图6。
表1 2024年各注册分类中药IND、NDA受理情况
|
注册 申请 类别 |
注册分类 |
中药 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新药 |
1.1 |
61 |
55 |
|
1.2 |
17 |
14 |
||
|
1.3 |
2 |
2 |
||
|
改良型新药 |
2.2 |
1 |
1 |
|
|
2.3 |
18 |
15 |
||
|
同名同方药 |
4 |
1 |
1 |
|
|
合计 |
100 |
88 |
||
|
NDA |
创新药 |
1.1 |
11 |
11 |
|
改良型新药 |
2.3 |
1 |
1 |
|
|
古代经典名方 |
3.1 |
28 |
17 |
|
|
合计 |
40 |
29 |
||
|
总计 |
140 |
117 |
||
2.化学药品注册申请受理情况
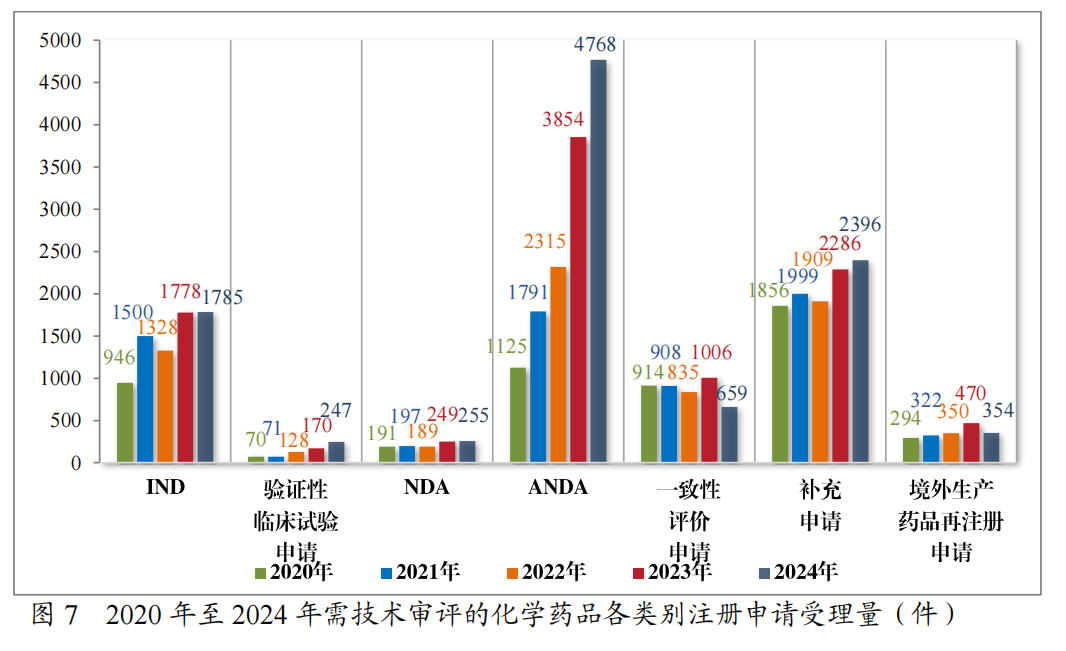
2024年受理需技术审评的化学药品注册申请10464件,按注册申请类别统计,IND 1785件,验证性临床试验申请247件,NDA255件,ANDA4768件,一致性评价申请659件,补充申请2396件,境外生产药品再注册申请354件。2020年至2024年需技术审评的化学药品各类别注册申请受理情况详见图7。
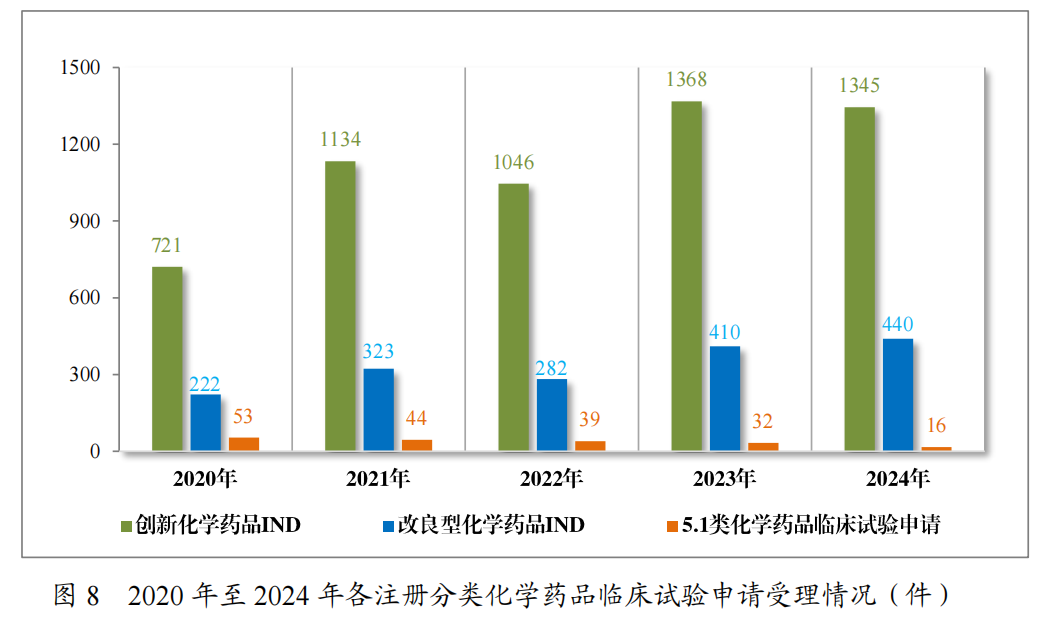
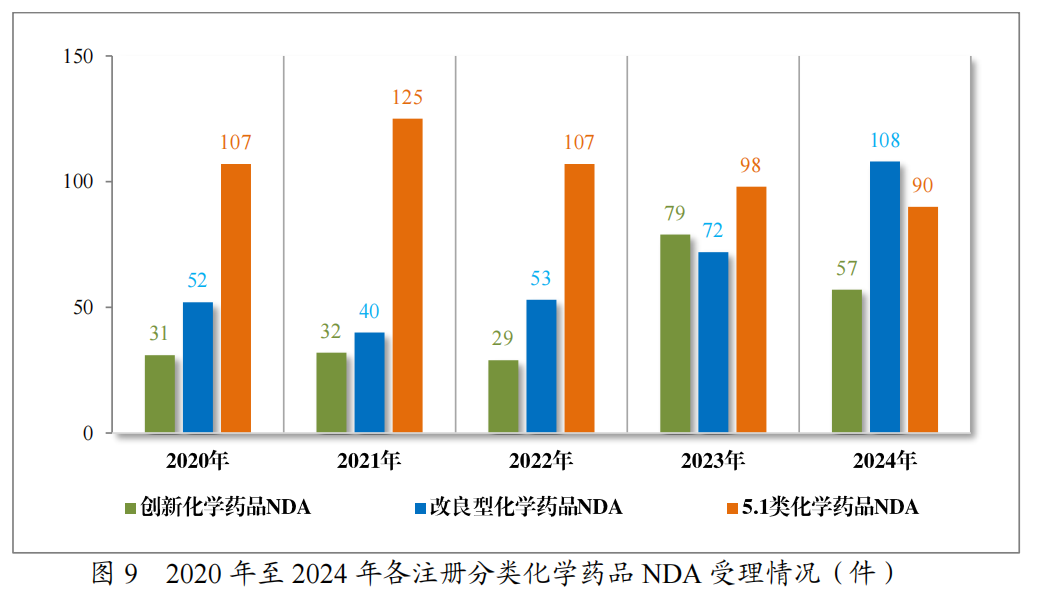
以注册分类统计,1785件IND中,包括创新化学药品IND 1345件(568个品种),改良型化学药品IND440件(237个品种);255件NDA中,包括创新化学药品NDA57件(38个品种),改良型化学药品NDA108件(46个品种),5.1类化学药品NDA90件(57个品种)。
2024年各注册分类化学药品IND、NDA受理情况详见表2,2020年至2024年各注册分类化学药品临床试验申请受理情况详见图8,
2020年至2024年各注册分类化学药品NDA受理情况详见图9。
表2 2024年各注册分类化学药品IND、NDA受理情况
|
注册申请类别 |
注册分类 |
化学药品 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新药 |
1 |
1345 |
568 |
|
改良型新药 |
2.1 |
10 |
5 |
|
|
2.1;2.2 |
3 |
2 |
||
|
2.1;2.2;2.4 |
9 |
4 |
||
|
2.1;2.4 |
2 |
1 |
||
|
2.2 |
218 |
113 |
||
|
2.2;2.3 |
1 |
1 |
||
|
2.2;2.3;2.4 |
3 |
1 |
||
|
2.2;2.4 |
35 |
20 |
||
|
2.3 |
33 |
26 |
||
|
2.3;2.4 |
1 |
1 |
||
|
2.4 |
125 |
63 |
||
|
合计 |
1785 |
805 |
||
|
NDA |
创新药 |
1 |
57 |
38 |
|
改良型新药 |
2.2 |
48 |
21 |
|
|
2.2;2.4 |
3 |
2 |
||
|
2.3 |
1 |
1 |
||
|
2.4 |
56 |
22 |
||
|
境外上市原研药和改良型药品 |
5.1 |
90 |
57 |
|
|
合计 |
255 |
141 |
||
|
总计 |
2040 |
946 |
||
注:部分注册申请同时符合《化学药品注册分类及申报资料要求》中的多个类别,故申请人同时填写了多个注册分类信息。
3.生物制品注册申请受理情况
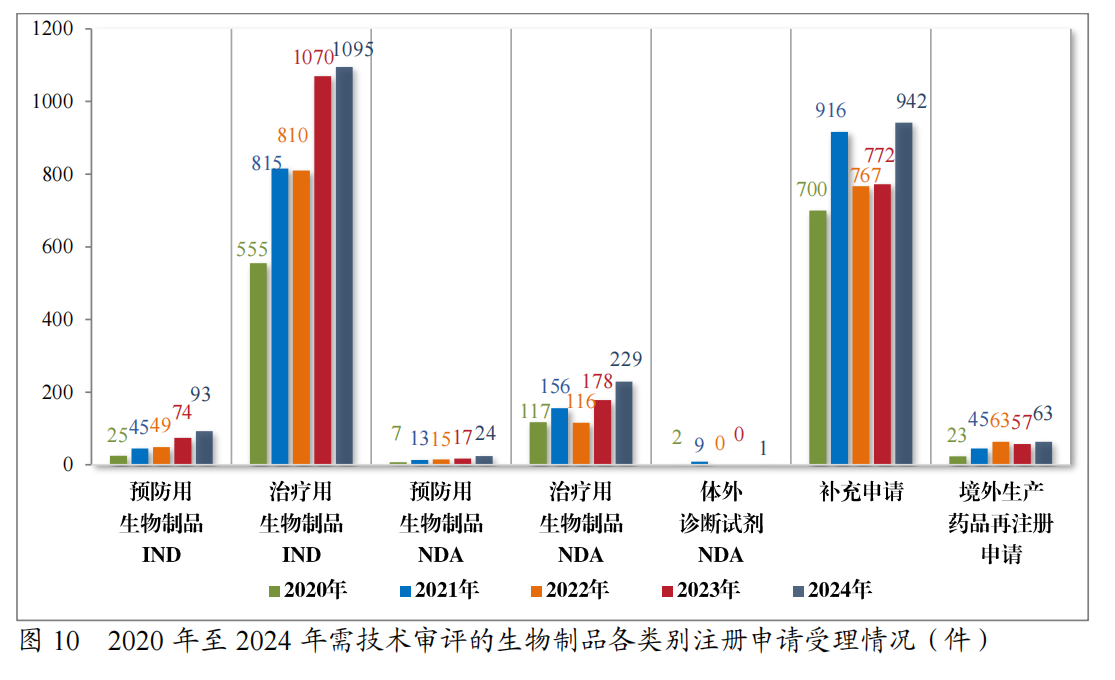
2024年受理生物制品注册申请2447件,包括预防用生物制品注册申请239件、治疗用生物制品注册申请2201件和体外诊断试剂7件。
按注册申请类别统计,IND 1188件,NDA254件,补充申请942件,境外生产药品再注册申请63件。2020年至2024年需技术审评的生物制品各类别注册申请受理情况详见图10。
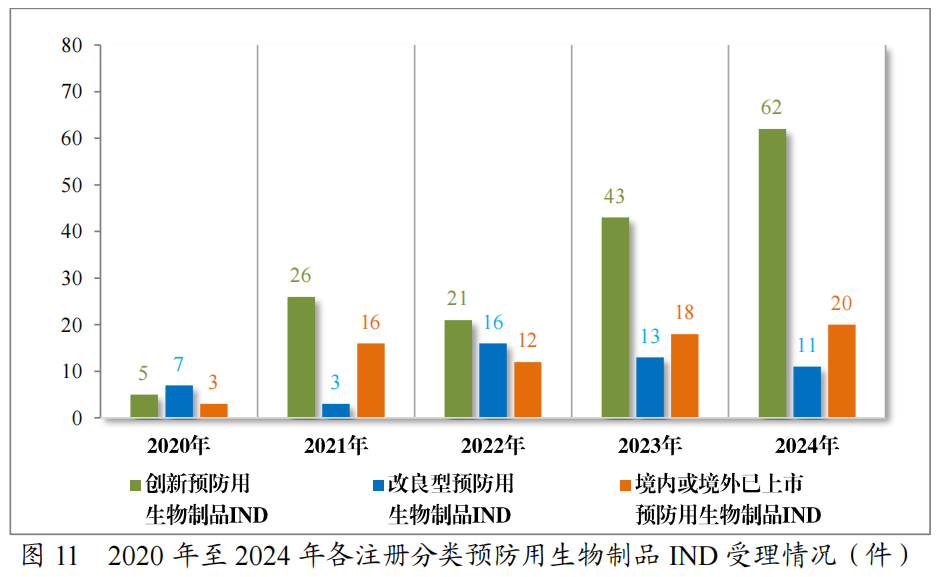
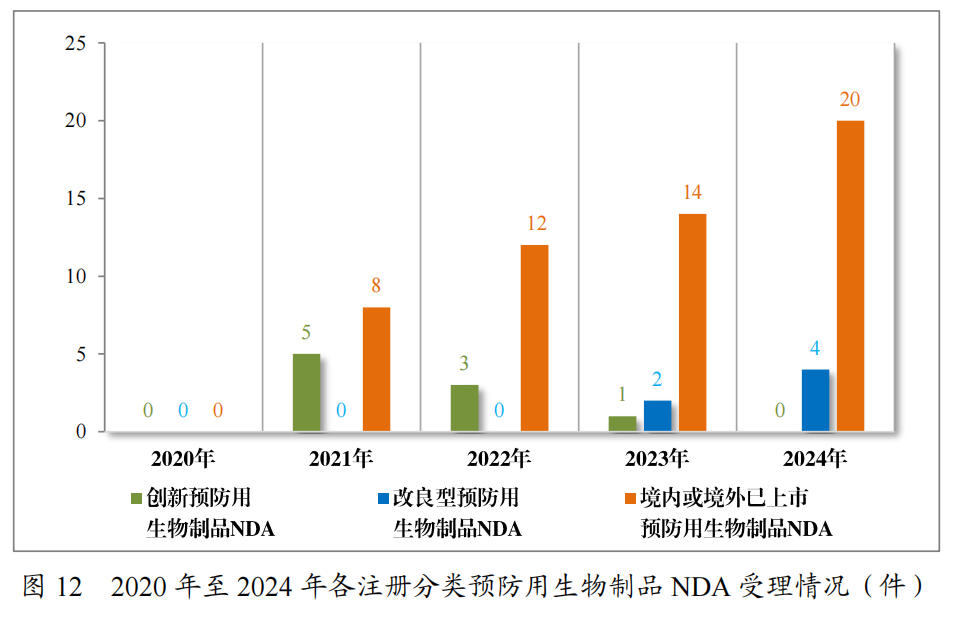
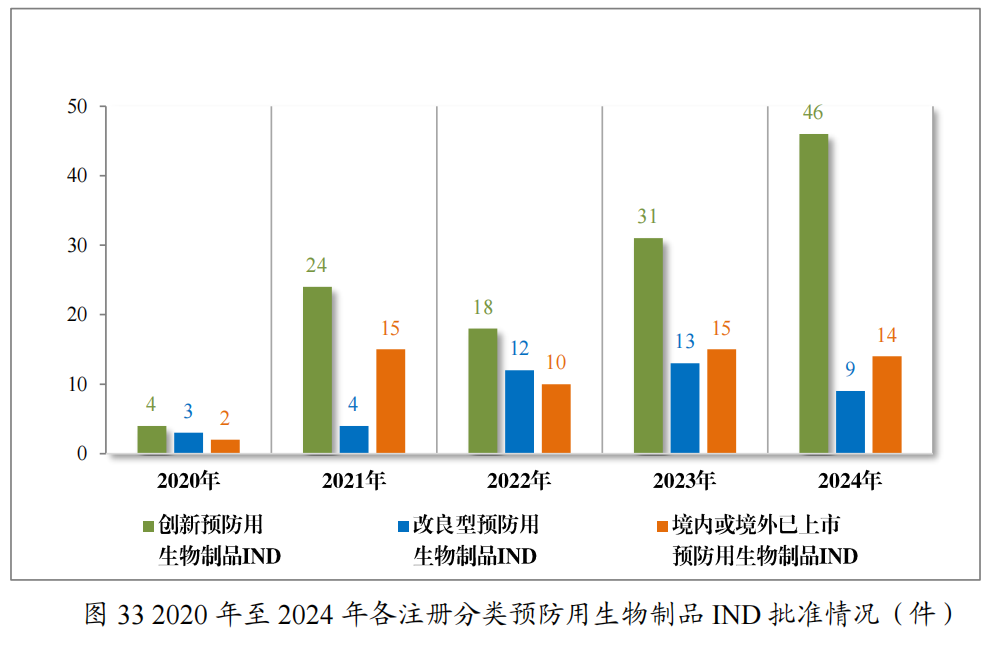
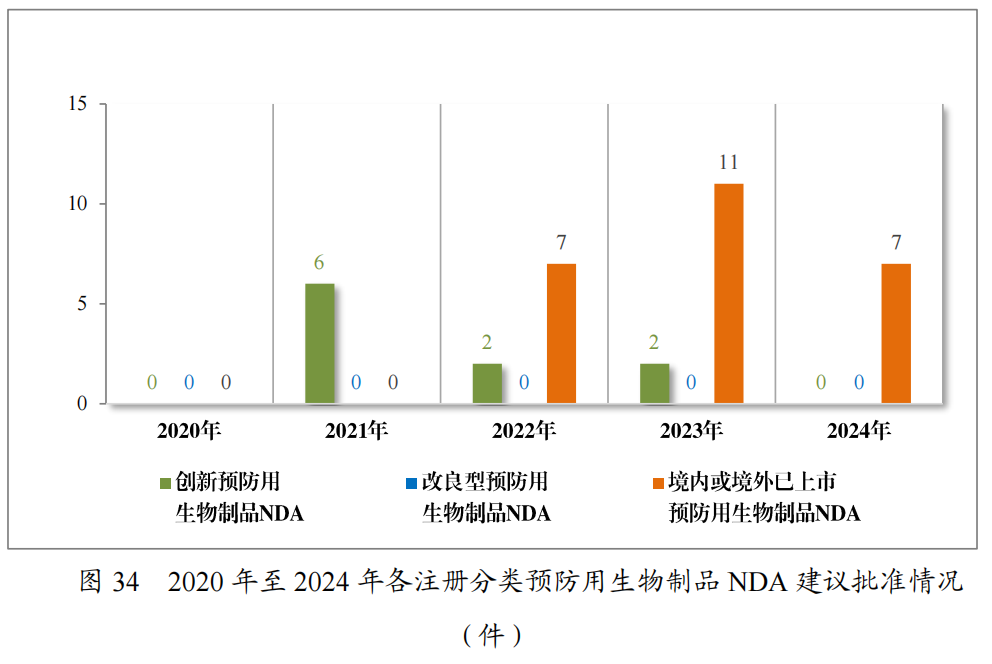
以注册分类统计,预防用生物制品IND93件中,包括创新预防用生物制品IND62件(41个品种),改良型预防用生物制品IND 11件(8个品种),境内或境外已上市预防用生物制品IND 20件(16个品种);预防用生物制品NDA24件中,包括改良型预防用生物制品NDA4件(3个品种),境内或境外已上市预防用生物制品NDA20件(14个品种)。
2024年各注册分类预防用生物制品IND、NDA受理情况详见表3,2020年至2024年各注册分类预防用生物制品IND受理情况详见图11,2020年至2024年各注册分类预防用生物制品NDA受理情况详见图12。
表3 2024年各注册分类预防用生物制品IND、NDA受理情况
|
注册申 请类别 |
注册分类 |
预防用生物制品 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新型疫苗 |
1.1 |
10 |
7 |
|
1.2 |
31 |
19 |
||
|
1.3 |
11 |
6 |
||
|
1.4 |
10 |
9 |
||
|
改良型疫苗 |
2.2 |
8 |
5 |
|
|
2.5 |
2 |
2 |
||
|
2.6 |
1 |
1 |
||
|
境内或境外已上市疫苗 |
3.1 |
4 |
4 |
|
|
3.2 |
1 |
1 |
||
|
3.3 |
15 |
11 |
||
|
合计 |
93 |
65 |
||
|
NDA |
改良型疫苗 |
2.2 |
4 |
3 |
|
境内或境外已上市疫苗 |
3.1 |
1 |
1 |
|
|
3.2 |
2 |
2 |
||
|
3.3 |
17 |
11 |
||
|
合计 |
24 |
17 |
||
|
总计 |
117 |
82 |
||
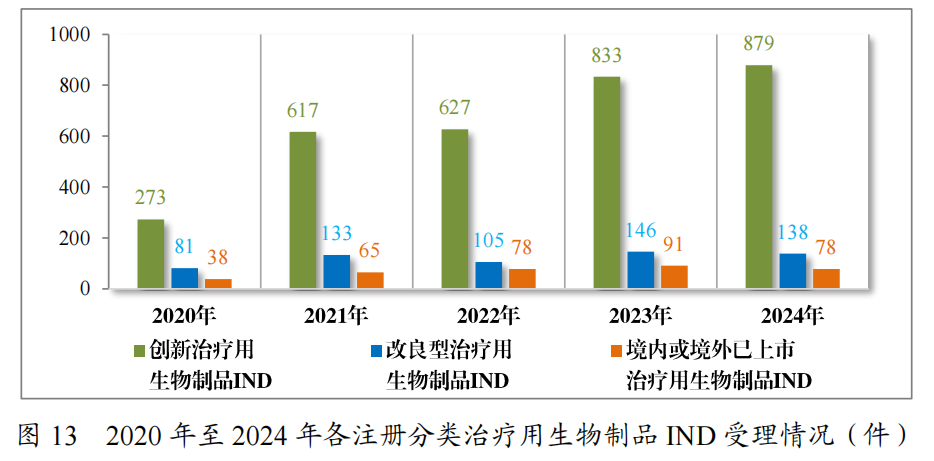
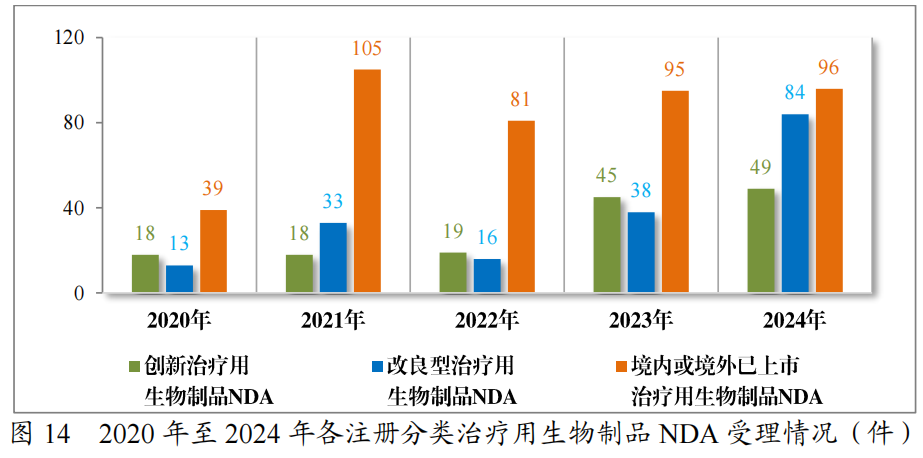
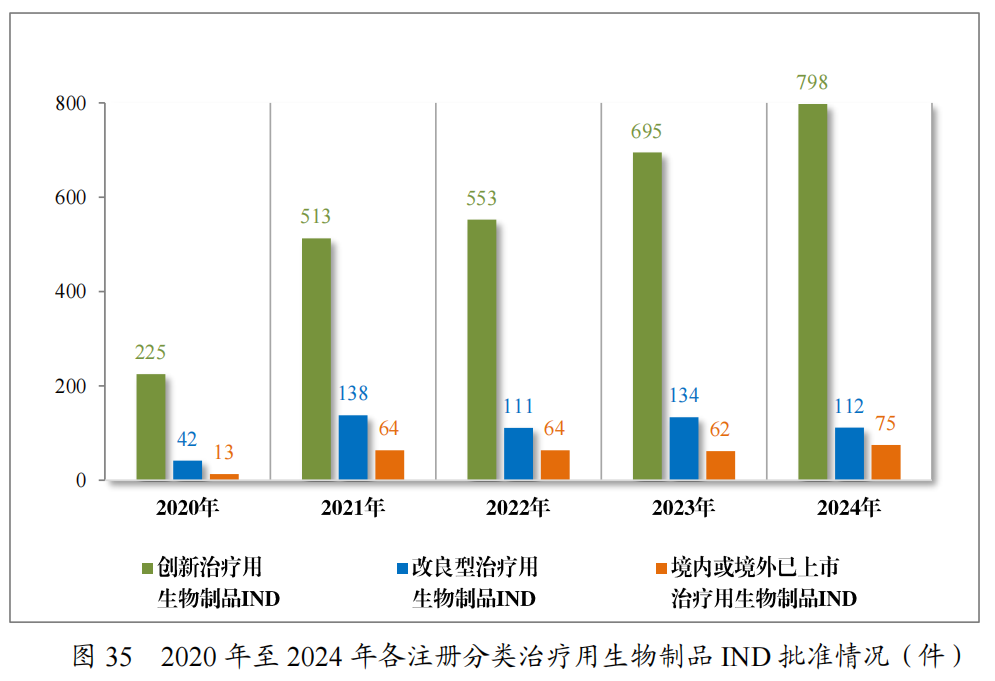
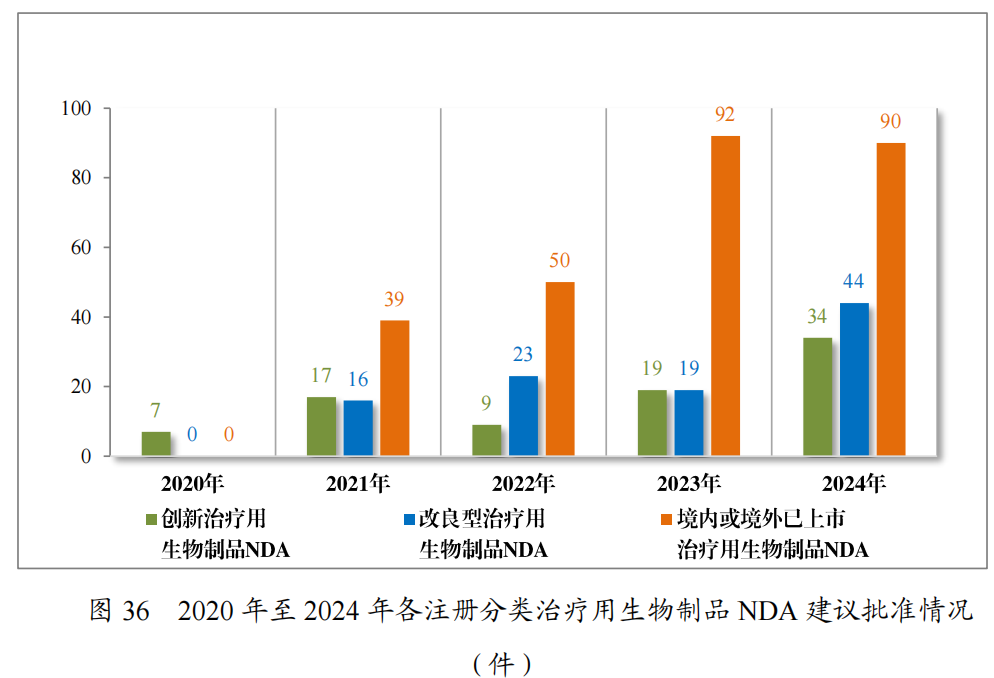
以注册分类统计,治疗用生物制品IND1095件中,包括创新治疗用生物制品IND 879件(563个品种),改良型治疗用生物制品IND138件(65个品种),境内或境外已上市治疗用生物制品IND78件(43个品种)。
治疗用生物制品NDA229件中,包括创新治疗用生物制品NDA49件(33个品种),改良型治疗用生物制品NDA84件(42个品种),境内或境外已上市治疗用生物制品NDA 96件(51个品种)。
2024年各注册分类治疗用生物制品IND、NDA受理情况详见表4,2020年至2024年各注册分类治疗用生物制品IND受理情况详见图13,2020年至2024年各注册分类治疗用生物制品NDA受理情况详见图14。
表4 2024各注册分类治疗用生物制品IND、NDA受理情况
|
注册申请类别 |
注册分类 |
治疗用生物制品 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新型生物制品 |
1 |
879 |
563 |
|
改良型生物制品 |
2.1 |
10 |
3 |
|
|
2.1;2.2 |
6 |
4 |
||
|
2.2 |
115 |
52 |
||
|
2.2;2.4 |
1 |
1 |
||
|
2.4 |
6 |
5 |
||
|
境内或境外已上市生物制品 |
3.1 |
11 |
8 |
|
|
3.2 |
7 |
5 |
||
|
3.3 |
49 |
21 |
||
|
3.4 |
11 |
9 |
||
|
合计 |
1095 |
671 |
||
|
NDA |
创新型生物制品 |
1 |
49 |
33 |
|
改良型生物制品 |
2.1 |
7 |
2 |
|
|
2.1;2.2 |
2 |
1 |
||
|
2.2 |
69 |
37 |
||
|
2.3 |
3 |
1 |
||
|
2.4 |
3 |
1 |
||
|
境内或境外已上市生物制品 |
3.1 |
52 |
28 |
|
|
3.2 |
8 |
5 |
||
|
3.3 |
28 |
11 |
||
|
3.4 |
8 |
7 |
||
|
合计 |
229 |
126 |
||
|
总计 |
1324 |
797 |
||
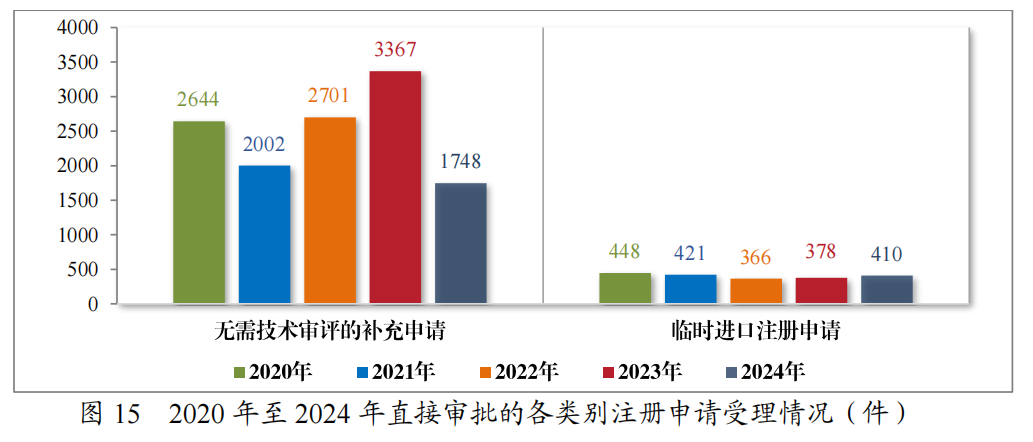
(三)直接行政审批类注册申请受理情况
2024年受理直接行政审批类注册申请2158件,包括无需技术审评的补充申请1748件,临时进口注册申请410件。2020年至2024年直接行政审批的各类别注册申请受理情况详见图15。
第二章药品注册申请审评审批情况
(一)总体情况
2024年,药审中心审结各类药品注册申请共18259件(同比增加16.20%),包括药品制剂注册申请16117件(同比增加10.98%),化学原料药注册申请2142件(同比增加80.00%)。16117件药品制剂注册申请包含技术审评类注册申请13913件(同比增加30.74%),直接行政审批类注册申请2204件。2020年至2024年药品注册申请审结量详见图16。
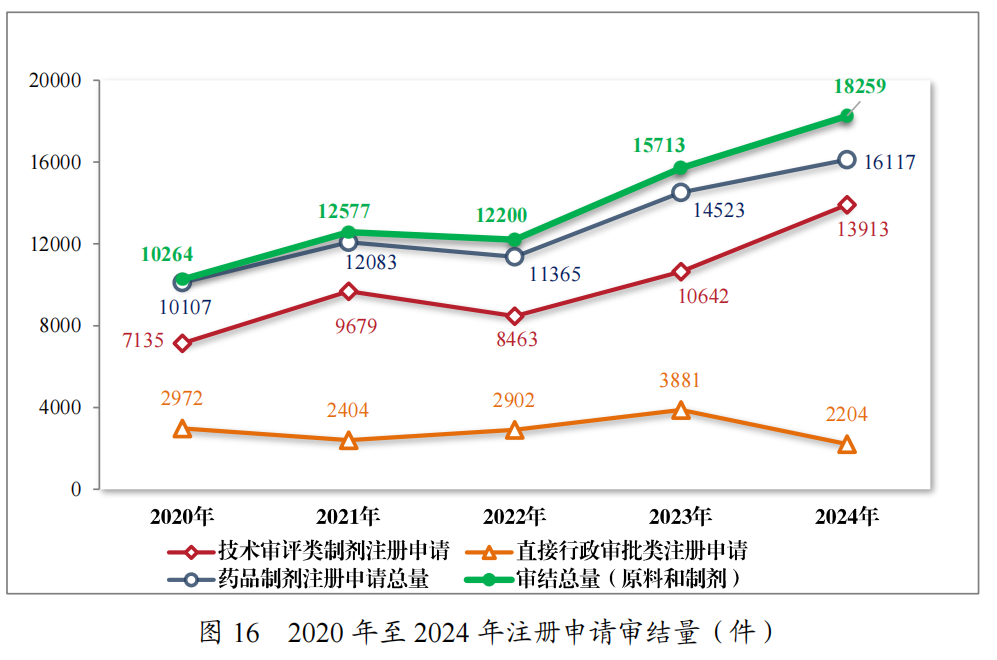
截至2024年底,在审和待审的药品注册申请共12323件,其中包含原料药注册申请2130件;待申请人回复补充资料的注册申请共
2239件,其中包含原料药注册申请587件。
(二)技术审评类注册申请审结情况
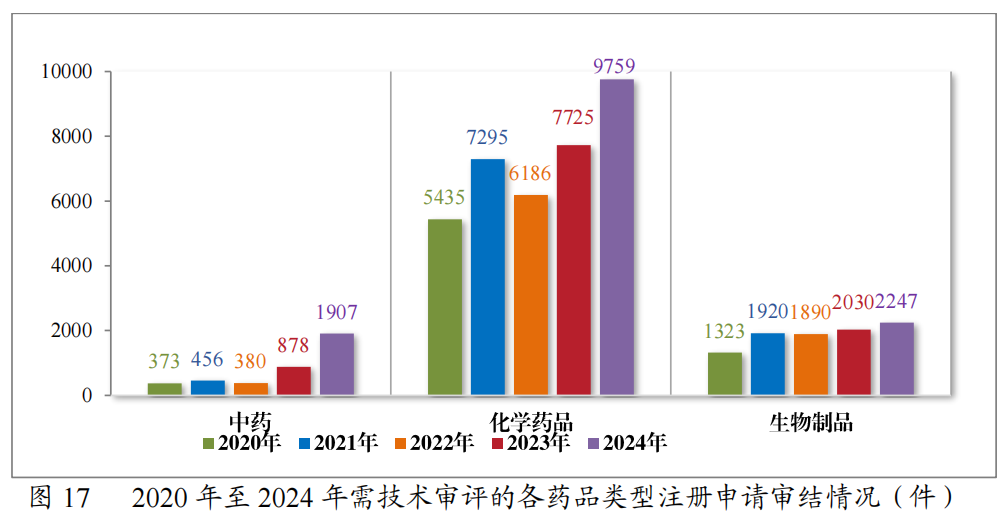
2024年审结的13913件技术审评类注册申请中,以药品类型统计,中药注册申请1907件,化学药品注册申请9759件,生物制品注册申请2247件。2020年至2024年需技术审评的各药品类型注册申请审结情况详见图17。
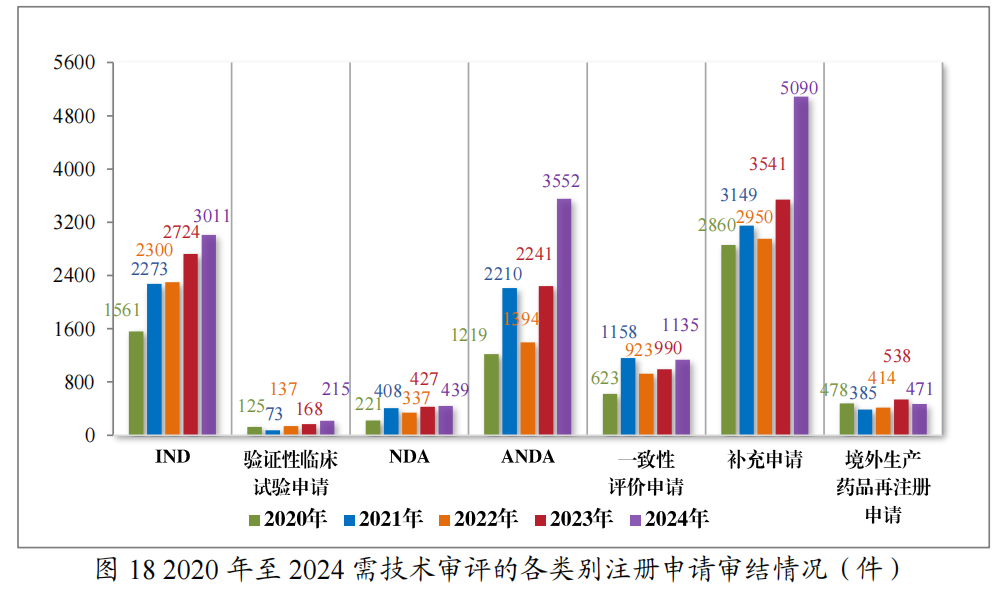
以注册申请类别统计,2024年审结IND 3011件,验证性临床试验申请215件,NDA 439件,ANDA 3552件,一致性评价申请1135件,补充申请5090件,境外生产药品再注册申请471件。2020年至2024年需技术审评的各类别注册申请审结情况详见图18。
2024年,药审中心以临床价值为导向,采取多种措施提高审评效率,加快新药好药上市,为患者提供更多的用药选择。
全年批准上市1类创新药48个品种1(详见附件1),其中17个品种(35.4%)通过优先审评审批程序批准上市,11个品种(22.9%)附条件批准上市,13个品种(27.1%)在临床试验期间纳入了突破性治疗药物程序。
全年批准罕见病用药55个品种(未包括化学药品4类仿制药),其中20个品种(36.4%)通过优先审评审批程序加快上市(详见附件2),2个品种附条件批准上市。
全年批准儿童用药106个品种,包含71个上市许可申请,其中20个品种(18.9%)通过优先审评审批程序加快上市(详见附件3);另批准35个品种扩展儿童适应症。
全年批准境外已上市境内未上市的药品(化学药品5.1类、治疗用生物制品3.1类和预防用生物制品3.1类)89个品种,其中64个为首次批准上市,25个为已上市药品增加适应症,详见附件4。
1.中药注册申请审结情况
2024年审结中药注册申请1907件,按注册申请类别统计,IND75件,NDA16件,补充申请1808件,境外生产药品再注册申请8件。2024年中药各类别注册申请审结情况详见表5。
表5 2024年需技术审评的中药注册申请审结情况(件)
|
注册申请类别 |
审结量 |
|||
|
批准/建议批准 |
不批准 /建议不批准 |
其他 |
合计 |
|
|
IND |
61 |
0 |
14 |
75 |
|
NDA |
14 |
0 |
2 |
16 |
|
补充申请 |
1705 |
6 |
97 |
1808 |
|
境外生产药品再注册 申请 |
8 |
0 |
0 |
8 |
|
总计 |
1788 |
6 |
113 |
1907 |
注:“其他”是指申请人未按规定缴纳费用、撤回申请等原因导致审评审批终止的情形。
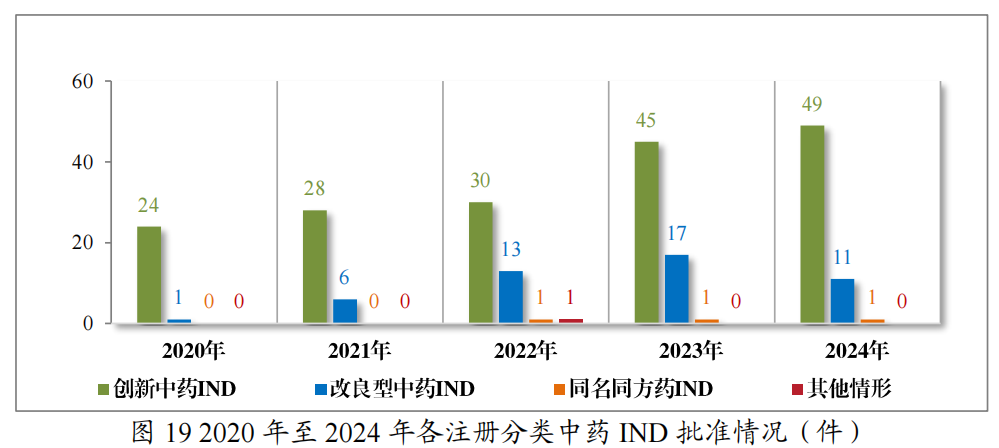
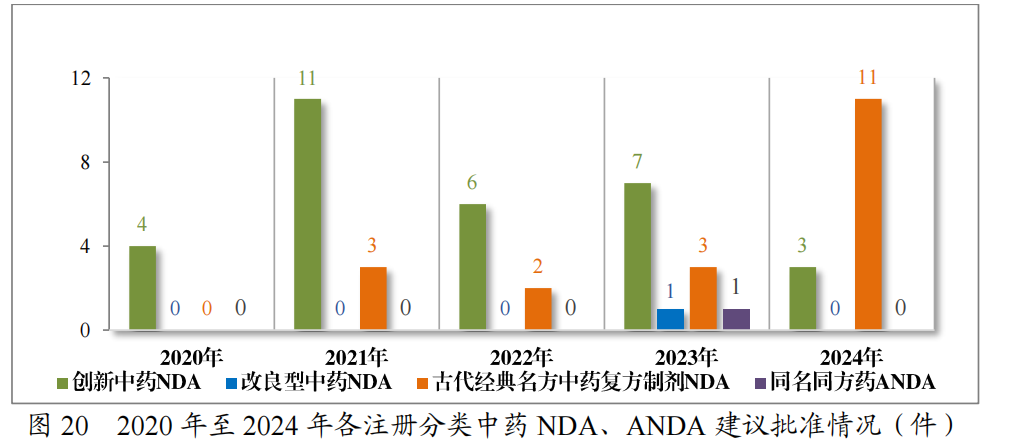
批准中药IND 61件(56个品种),以注册分类统计,包括创新中药IND49件(44个品种),改良型中药IND 11件(11个品种),同名同方药IND 1件(1个品种);建议批准的中药NDA 14件(14个品种)中,包括创新中药NDA 3件(3个品种),古代经典名方中药复方制剂NDA11件(11个品种)。
2024年各注册分类中药IND、NDA批准/建议批准情况详见表6,2020年至2024年各注册分类中药IND批准情况详见图19,2020年至2024年各注册分类中药NDA、ANDA建议批准情况详见图20。
表6 2024年各注册分类中药IND、NDA批准/建议批准量
|
注册申请类别 |
注册分类 |
中药 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新药 |
1.1 |
45 |
42 |
|
1.2 |
4 |
2 |
||
|
改良型新药 |
2.3 |
11 |
11 |
|
|
同名同方药 |
4 |
1 |
1 |
|
|
合计 |
61 |
56 |
||
|
NDA |
创新药 |
1.1 |
3 |
3 |
|
古代经典名 方 |
3.1 |
9 |
9 |
|
|
3.2 |
2 |
2 |
||
|
合计 |
14 |
14 |
||
|
总计 |
总计 |
75 |
70 |
|
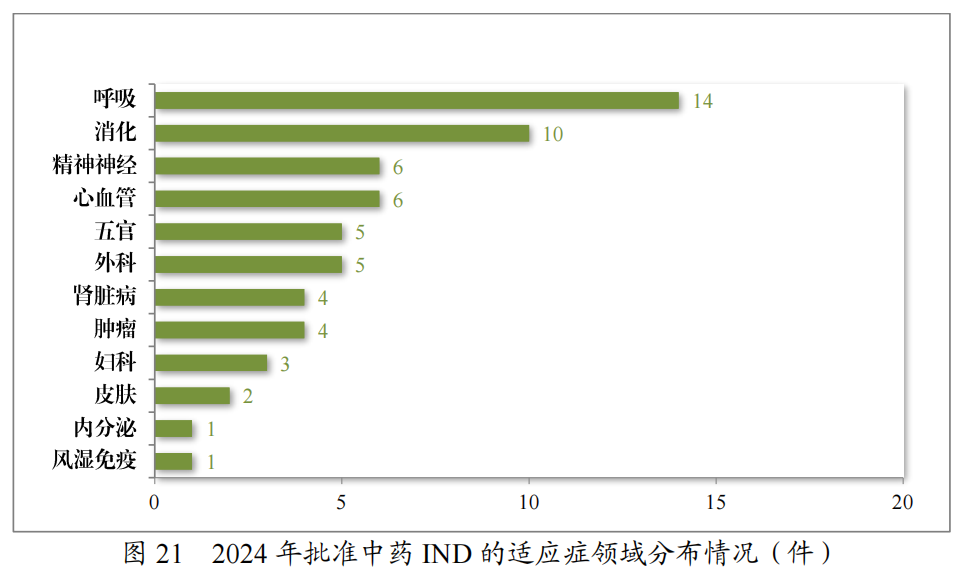
批准的61件中药IND中,涉及12个适应症领域,其中呼吸、消化药物较多,占中药IND批准量的39.34%。2024年批准中药IND的适应症领域分布情况详见图21。
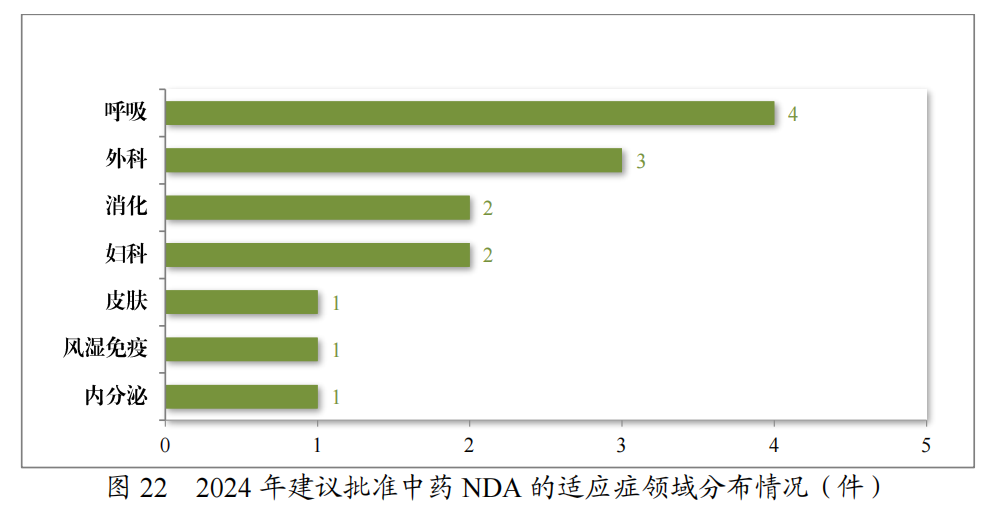
建议批准的中药NDA 14件中,涉及6个适应症领域,其中呼吸药物较多,占中药NDA建议批准量的28.57%。2024年建议批准中药NDA的适应症领域分布情况详见图22。
2.化学药品注册申请审结情况
2024年审结化学药品注册申请9759件,按注册申请类别统计,临床试验申请1994件,NDA230件,ANDA3552件,一致性评价申请1135件,补充申请2449件,境外生产药品再注册申请399件。2024年化学药品各类别注册申请审结情况详见表7。
表7 2024年需技术审评的化学药品注册申请审结情况(件)
|
注册申请类别 |
审结量 |
|||
|
批准/建议 批准 |
不批准 /建议不批准 |
其他 |
合计 |
|
|
IND |
1652 |
23 |
104 |
1779 |
|
验证性临床试验申请 |
200 |
0 |
15 |
215 |
|
NDA |
204 |
3 |
23 |
230 |
|
ANDA |
3041 |
83 |
428 |
3552 |
|
一致性评价申请 |
1011 |
19 |
105 |
1135 |
|
补充申请 |
2156 |
40 |
253 |
2449 |
|
境外生产药品再注册申请 |
395 |
0 |
4 |
399 |
|
总计 |
8659 |
168 |
932 |
9759 |
(1)新药临床试验申请和新药上市申请
批准化学药品IND1652件,以注册分类统计,包括创新化学药品IND1247件(538个品种),改良型化学药品IND405件(219个品种);建议批准化学药品NDA204件(123个品种),以注册分类统计,包括创新化学药品NDA41件(29个品种),改良型化学药品NDA58件(32个品种),5.1类化学药品NDA105件(62个品种)。
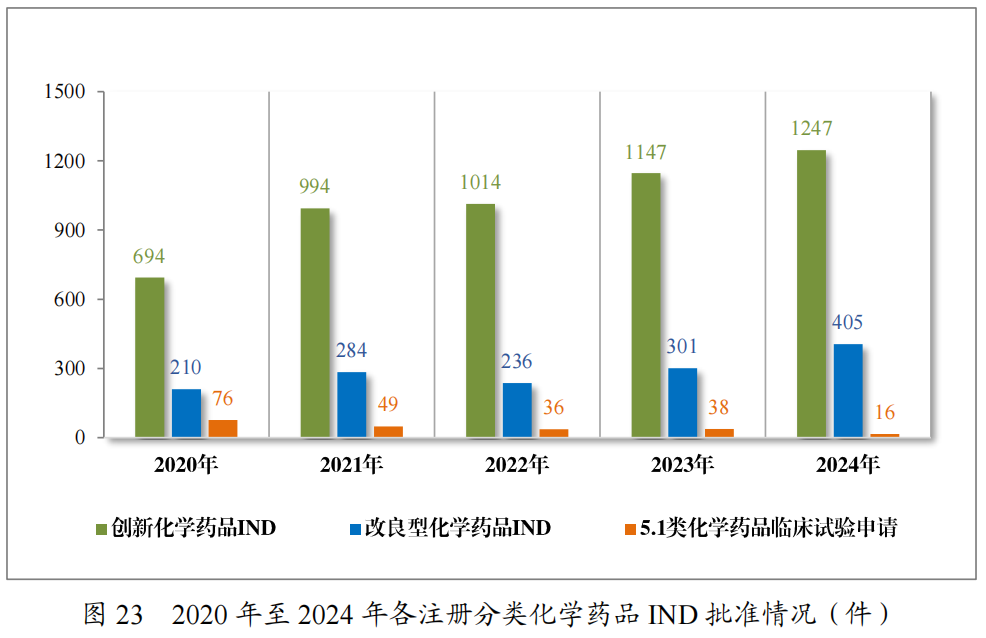
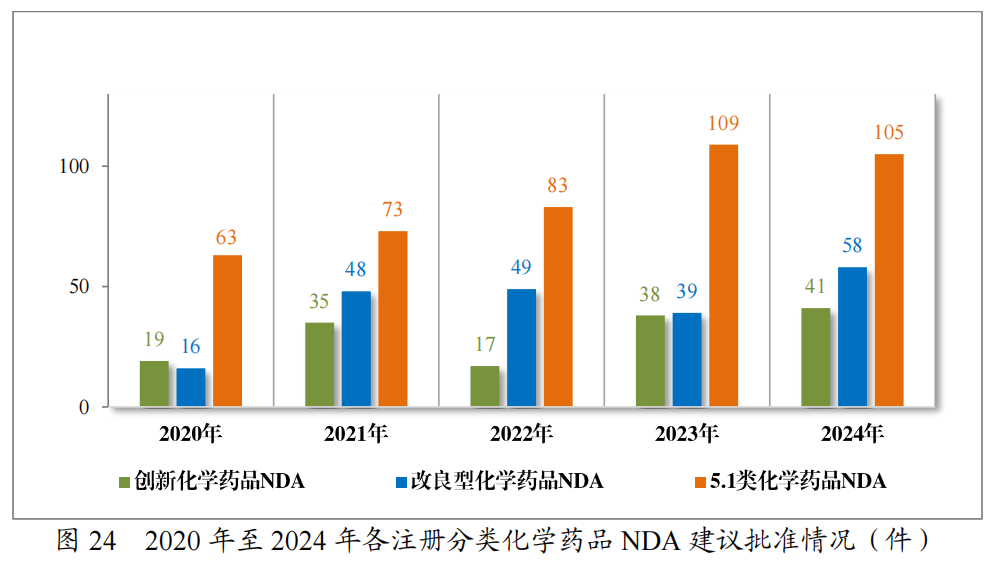
2024年各注册分类化学药品IND、NDA批准/建议批准情况详见表8,2020年至2024年各注册分类化学药品临床试验申请批准情况详见图23,2020年至2024年各注册分类化学药品NDA建议批准情况详见图24。
表8 2024年各注册分类化学药品IND、NDA批准/建议批准情况
|
注册申请类别 |
注册分类 |
化学药品 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新药 |
1 |
1247 |
538 |
|
改良型新药 |
2.1 |
7 |
4 |
|
|
2.1;2.2 |
3 |
2 |
||
|
2.1;2.2;2.4 |
7 |
3 |
||
|
2.2 |
183 |
101 |
||
|
2.2;2.3 |
1 |
1 |
||
|
2.2;2.3;2.4 |
3 |
1 |
||
|
2.2;2.4 |
31 |
19 |
||
|
2.3 |
31 |
23 |
||
|
2.3;2.4 |
2 |
2 |
||
|
2.4 |
137 |
63 |
||
|
合计 |
1652 |
757 |
||
|
NDA |
创新药 |
1 |
41 |
29 |
|
改良型新药 |
2.2 |
14 |
9 |
|
|
2.3 |
4 |
3 |
||
|
2.4 |
40 |
20 |
||
|
境外上市原研 药和改良型药 品 |
5.1 |
105 |
62 |
|
|
合计 |
204 |
123 |
||
|
总计 |
1856 |
880 |
||
批准的化学药品IND 1652件中,抗肿瘤药物占41.89%、皮肤及五官科药物占11.08%,内分泌系统药物占6.84%。2024年批准化学药品IND的适应症领域分布情况详见图25。
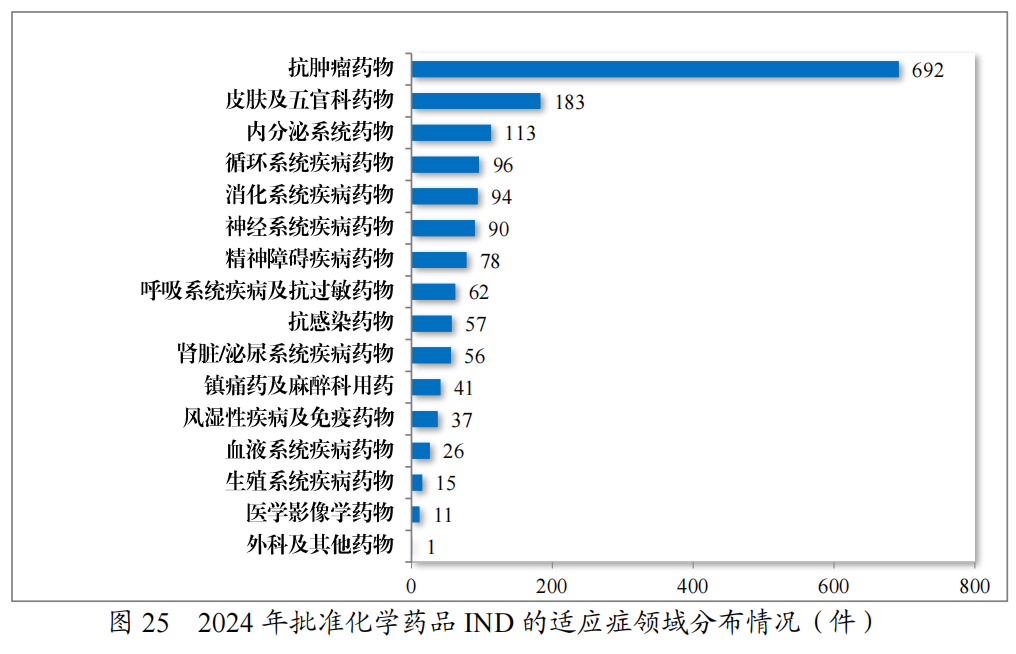
建议批准的化学药品NDA204件中,抗肿瘤药物占36.27%、内分泌系统药物占10.78%,神经系统疾病药物占9.31%。2024年建议批准化学药品NDA的适应症领域分布情况详见图26。
(2)化学仿制药上市申请
2024年建议批准化学仿制药上市申请3041件,其中首仿品种289个,有效满足了临床患者对高质量仿制药的需求。
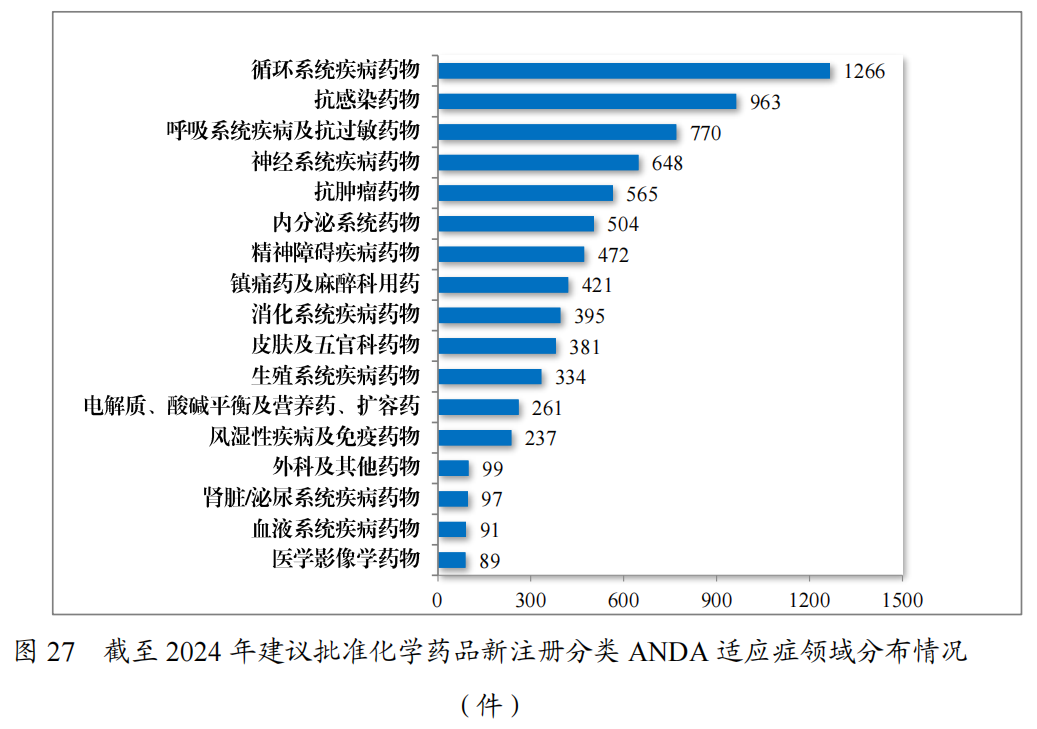
化学药品注册分类改革以来,药审中心按照与原研药品质量和疗效一致性的要求,累计建议批准化学仿制药7593件,涉及循环、抗感染、呼吸等17个治疗领域,具体见图27。
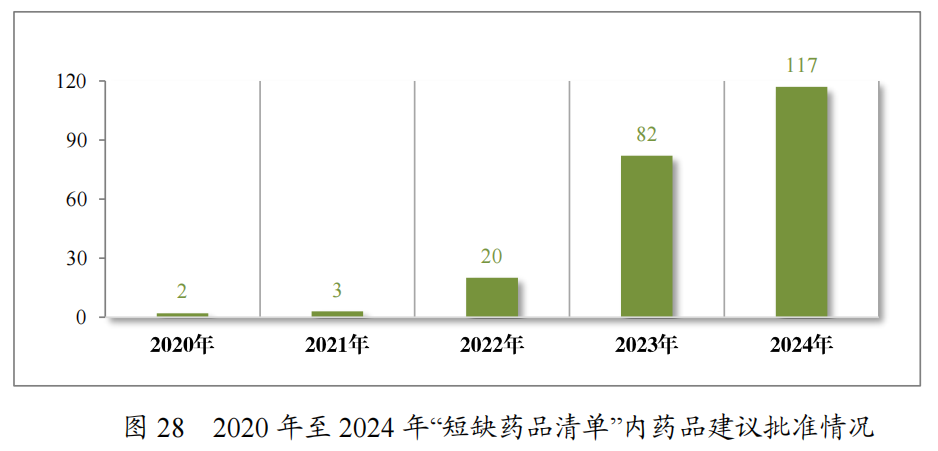
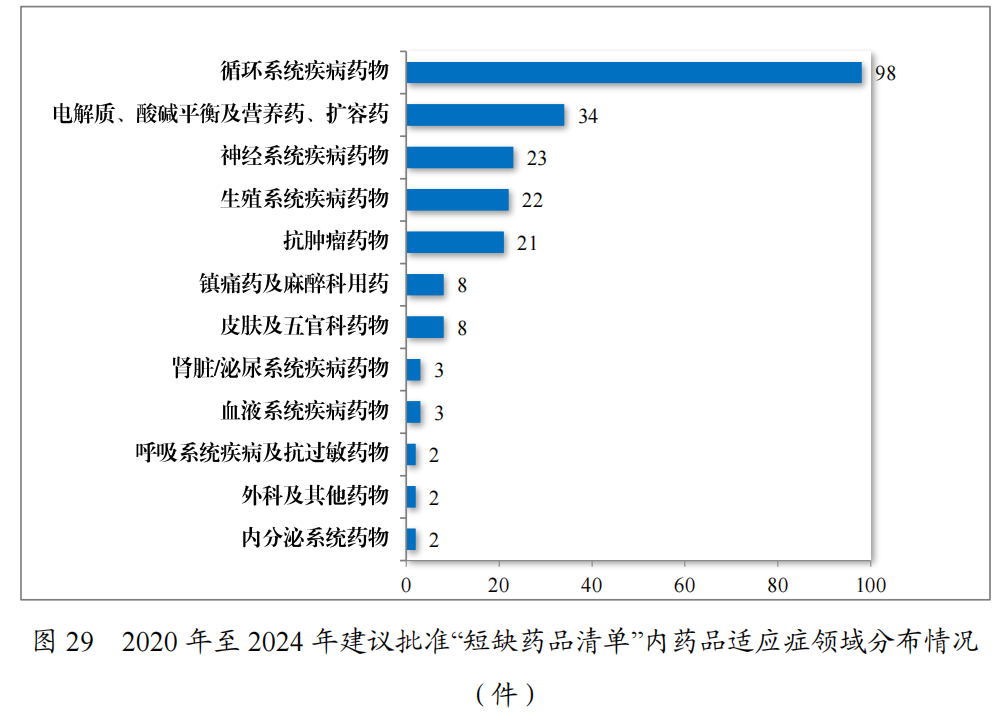
为落实《国务院办公厅关于进一步做好短缺药品保供稳价工作的意见》,2020年,国家卫生健康委员会等十二部门联合发布了国家短缺药品清单。2024年,药审中心共建议批准“国家短缺药品清单”内药品117件(21个品种)。近五年累计建议批准短缺药品共226件(30个品种),见图28,涉及循环、电解质、神经、肿瘤和生殖等12个治疗领域,具体见图29,有效保障了短缺药品的供应。
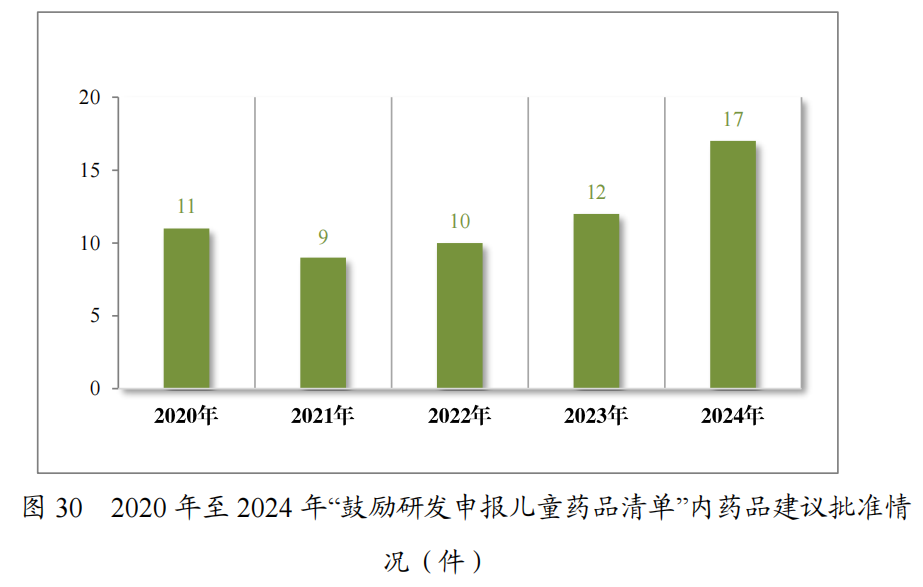
为进一步促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,自2016年起,国家卫生健康委员会会同有关部门研究制订了五批鼓励研发申报儿童药品清单,共有160 个品种,包括口服溶液剂、口服混悬剂、颗粒剂等适宜儿童给药剂型。2024年,药审中心建议批准鼓励研发申报儿童药品清单内的儿童用仿制药17件(14个品种)。近五年累计建议批准鼓励研发申报儿童药品清单
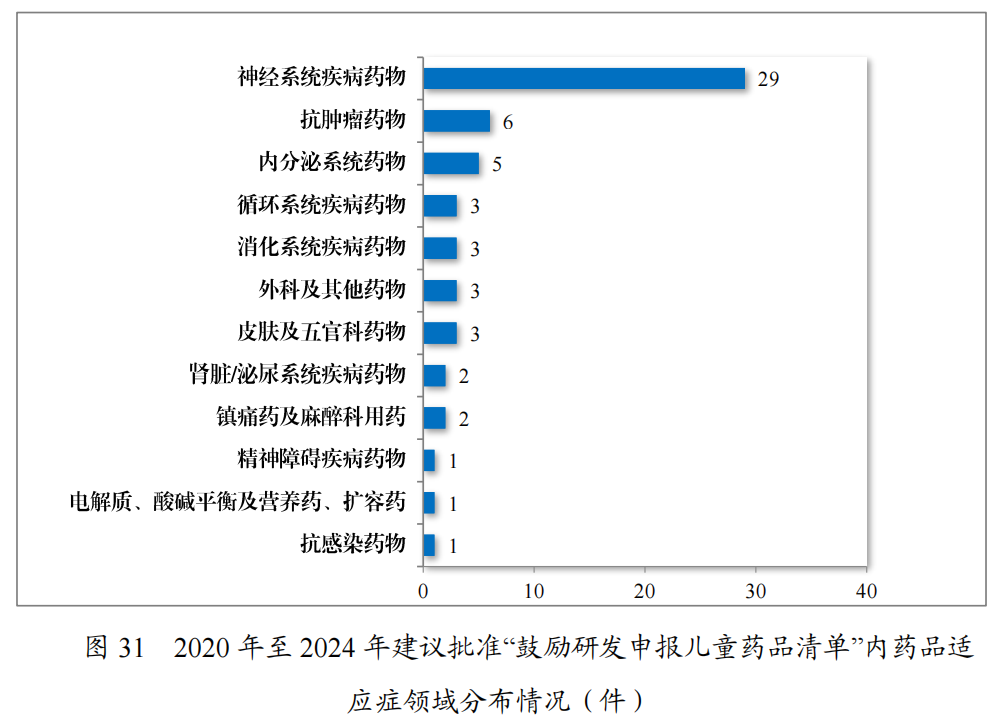
内的儿童用仿制药59件(26个品种),见图30,涉及神经、抗肿瘤、内分泌等8个治疗领域,具体涉及适应症情况请见图31。
(3)化学仿制药质量和疗效一致性评价工作
2024 年,药审中心持续推进化学仿制药质量和疗效一致性评价工作,为患者提供高质量仿制药,共发布参比制剂目录13批,涉及929个品规(161个品种)。截至2024年12月31 日,累计发布87批参比制剂目录,共7643个品规(2677个品种)。
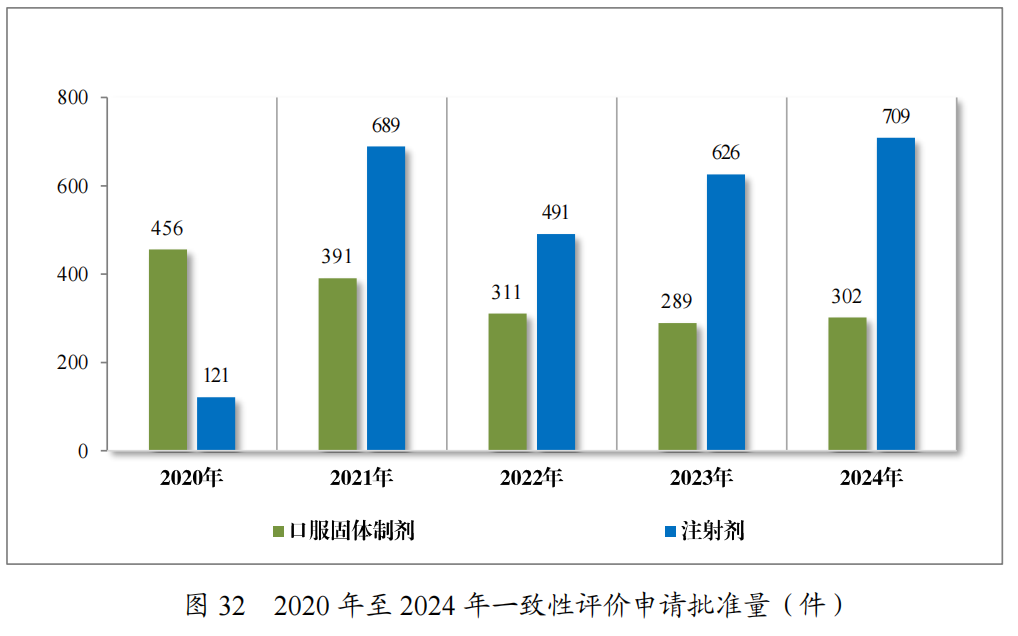
2024年批准一致性评价申请1011件(354个品种),其中,口服固体制剂302件(180个品种),注射剂709件(174个品种)。自化学仿制药质量和疗效一致性评价工作开展以来,累计批准一致性评价申请共4805件(共计756个品种),其中,口服固体制剂2137件(计465个品种),注射剂2668件(计291个品种)。2020年至2024年一致性评价申请批准情况详见图32。
3.生物制品注册申请审结情况
2024年,审结生物制品注册申请2247件,包括预防用生物制品184件,治疗用生物制品2054件和体外诊断试剂9件。
按注册申请类别统计,IND 1157件,NDA 193件,补充申请833件,境外生产药品再注册申请64件。2024年生物制品各类别注册申请审结情况详见表9。
表9 2024年需技术审评的生物制品注册申请审结情况(件)
|
注册申请类别 |
审结量 |
|||
|
批准/建议批准 |
不批准 /建议不批准 |
其他 |
合计 |
|
|
预防用生物制品IND |
69 |
0 |
11 |
80 |
|
治疗用生物制品IND |
985 |
15 |
77 |
1077 |
|
预防用生物制品NDA |
7 |
0 |
4 |
11 |
|
治疗用生物制品NDA |
168 |
3 |
11 |
182 |
|
补充申请 |
775 |
1 |
57 |
833 |
|
境外生产药品再注册 申请 |
63 |
0 |
1 |
64 |
|
总计 |
2067 |
19 |
161 |
2247 |
(1)预防用生物制品
批准预防用生物制品IND69件,以注册分类统计,包括创新预防用生物制品IND46件(33个品种),改良型预防用生物制品IND 9件(7个品种),境内或境外已上市预防用生物制品IND 14件(12个品种);建议批准预防用生物制品NDA7件(3个品种),以注册分类统计,均为境内或境外已上市预防用生物制品。
2024年各注册分类预防用生物制品IND、NDA批准/建议批准情况详见表10,2020年至2024年各注册分类预防用生物制品IND批准情况详见图33,2020年至2024年各注册分类预防用生物制品NDA建议批准情况详见图34。
表10 2024年各注册分类预防用生物制品IND、NDA批准/建议批准情况
|
注册申请类别 |
注册分类 |
预防用生物制品 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新型疫苗 |
1.1 |
8 |
5 |
|
1.2 |
22 |
17 |
||
|
1.3 |
8 |
4 |
||
|
1.4 |
8 |
7 |
||
|
改良型疫苗 |
2.2 |
6 |
4 |
|
|
2.3 |
1 |
1 |
||
|
2.5 |
1 |
1 |
||
|
2.6 |
1 |
1 |
||
|
境内或境外已 上市疫苗 |
3.1 |
3 |
3 |
|
|
3.2 |
1 |
1 |
||
|
3.3 |
10 |
8 |
||
|
合计 |
69 |
52 |
||
|
NDA |
境内或境外已 上市疫苗 |
3.1 |
4 |
1 |
|
3.3 |
3 |
2 |
||
|
合计 |
7 |
3 |
||
|
总计 |
76 |
55 |
||
(2)治疗用生物制品
批准治疗用生物制品IND 985件,以注册分类统计,包括创新治疗用生物制品IND 798件(531个品种),改良型治疗用生物制品IND112件(57个品种),境内或境外已上市治疗用生物制品IND75件(36个品种)。
建议批准治疗用生物制品NDA168件,以注册分类统计,包括创新治疗用生物制品NDA 34件(24个品种),改良型治疗用生物制品NDA44件(23个品种),境内或境外已上市治疗用生物制品NDA90件(49个品种),其中包括生物类似药(3.3类)25件(15个品种)。
2024年各注册分类治疗用生物制品IND、NDA批准/建议批准情况详见表11,2020年至2024年各注册分类治疗用生物制品IND批准情况详见图35,2020年至2024年各注册分类治疗用生物制品NDA建议批准情况详见图36。
表11 2024年各注册分类治疗用生物制品IND、NDA批准/建议批准情况
|
注册申请类别 |
注册分类 |
治疗用生物制品 |
||
|
注册申请(件) |
品种(个) |
|||
|
IND |
创新型生物制品 |
1 |
798 |
531 |
|
改良型生物制品 |
2.1 |
10 |
3 |
|
|
2.1;2.2 |
4 |
3 |
||
|
2.2 |
91 |
46 |
||
|
2.2;2.4 |
1 |
1 |
||
|
2.4 |
6 |
4 |
||
|
境内或境外已上市生物制品 |
3.1 |
13 |
6 |
|
|
3.2 |
3 |
3 |
||
|
3.3 |
48 |
17 |
||
|
3.4 |
11 |
10 |
||
|
合计 |
985 |
624 |
||
|
NDA |
创新型生物制品 |
1 |
34 |
24 |
|
改良型生物制品 |
2.1;2.2 |
1 |
1 |
|
|
2.2 |
42 |
21 |
||
|
2.4 |
1 |
1 |
||
|
境内或境外已上市生物制品 |
3.1 |
56 |
28 |
|
|
3.2 |
2 |
2 |
||
|
3.3 |
25 |
15 |
||
|
3.4 |
7 |
4 |
||
|
合计 |
168 |
96 |
||
|
总计 |
1153 |
720 |
||
批准的治疗用生物制品IND985件中,抗肿瘤药物占比55.43%,皮肤及五官科药物占比10.66%,内分泌系统药物占比7.31%。2024年批准治疗用生物制品IND的适应症领域分布情况详见图37。
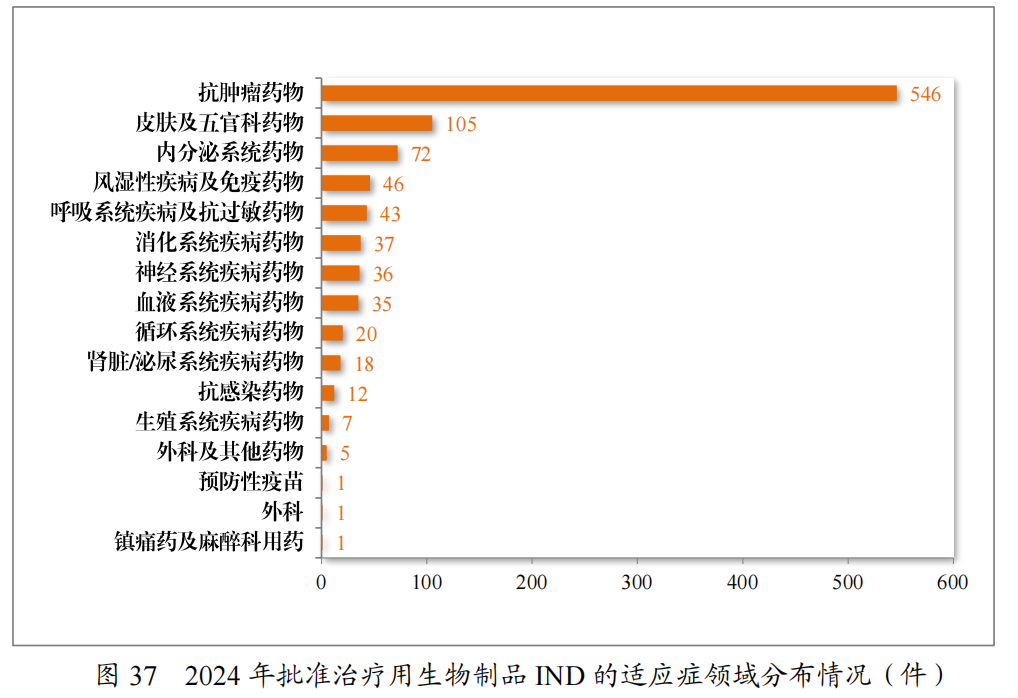
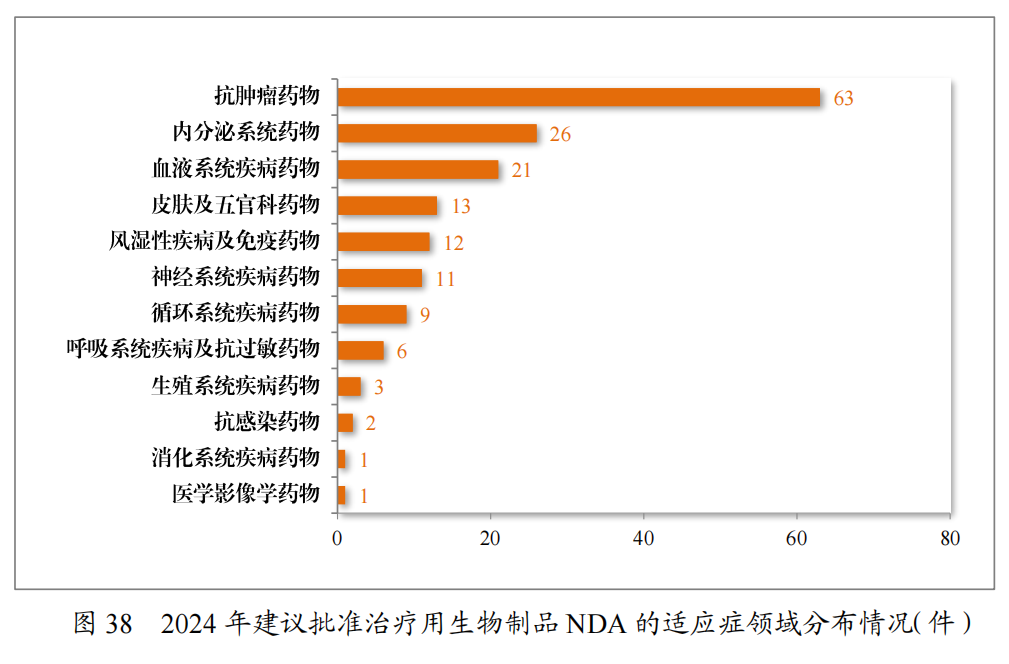
建议批准的治疗用生物制品NDA168 件中,抗肿瘤药物占比37.50%,内分泌系统药物占比15.48%,血液系统疾病药物12.50%。2024年建议批准治疗用生物制品NDA的适应症领域分布情况详见图38。
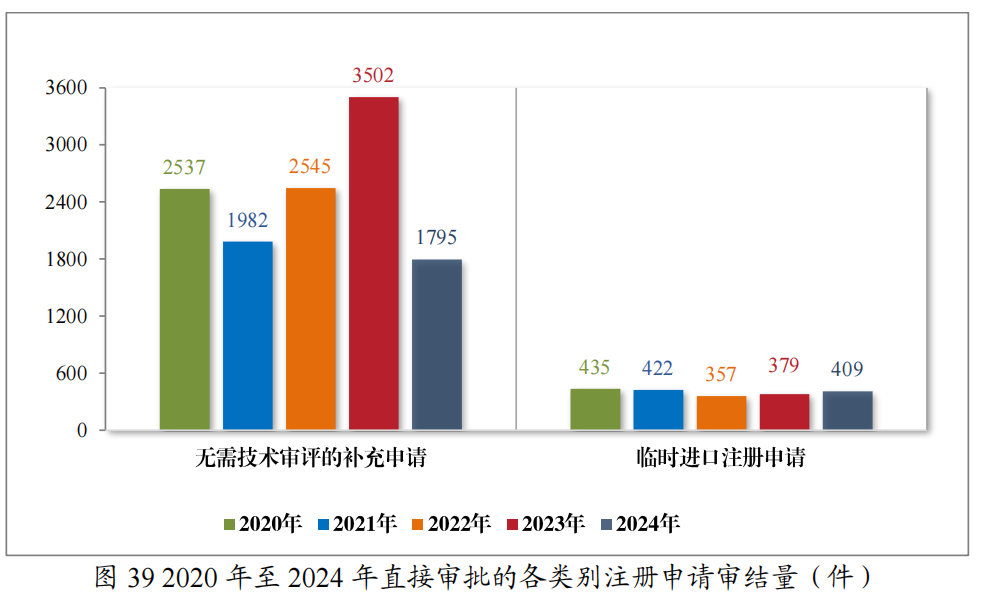
(三)直接行政审批类注册申请审结情况
2024年审结直接行政审批类注册申请2204件,其中无需技术审评的补充申请1795件,临时进口注册申请409件。2020年至2024年直接行政审批的各类别注册申请审结情况详见图39。
第三章药品加快上市注册情况
2024 年药审中心通过药品加快上市注册程序,加强与申请人的沟通交流,缩短药物研发与技术审评时间,加快临床急需新药好药上
市。
(一)突破性治疗药物程序
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。对于纳入突破性治疗程序的药物,其临床试验期间沟通交流包括首次沟通交流、因重大安全性问题/重大技术问题而召开的会议、药物临床试验关键阶段会议以及一般性技术问题咨询等,药审中心优先配置资源进行沟通交流,加强指导并促进药物研发。
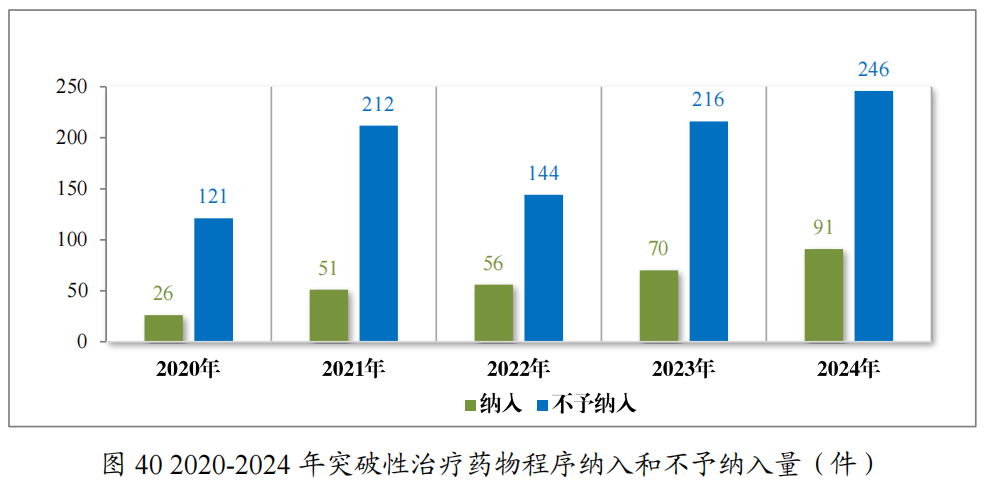
2024年共收到突破性治疗药物程序申请337件,同意纳入突破性治疗药物程序91件(84项适应症,见附件6),占申请数量的27.00%,较2023年增加30.00%。
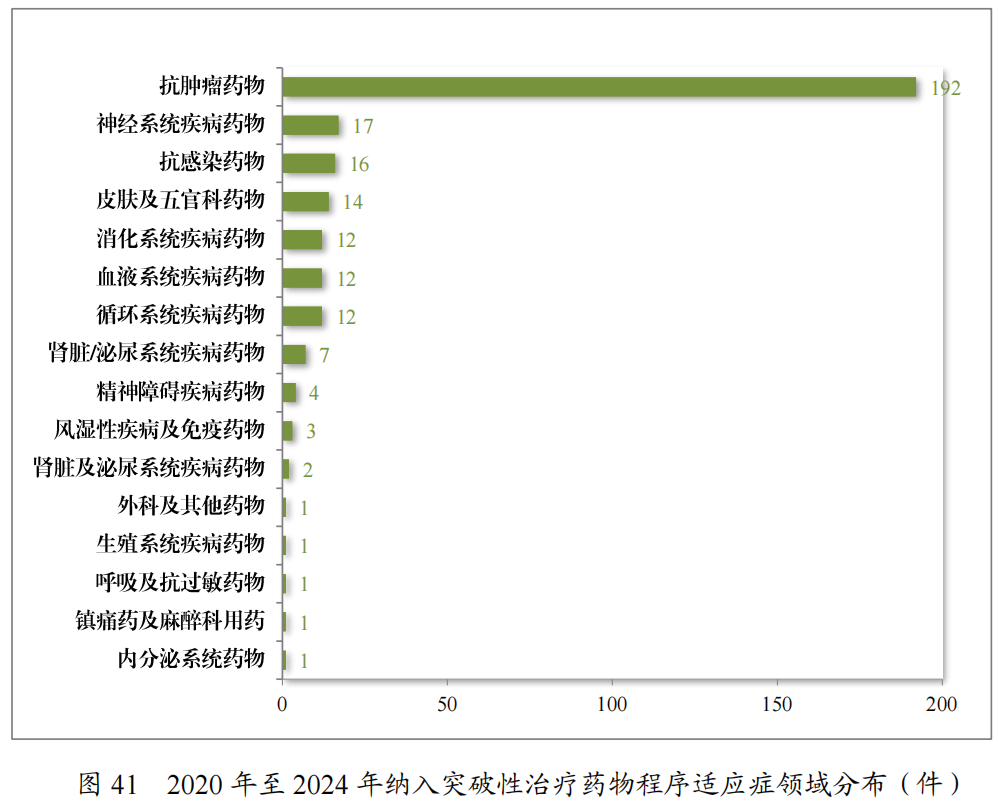
自2020年《药品注册管理办法》(总局第27号令)实施以来,累计纳入突破性治疗药物程序294件(246项适应症),排名前三的分别为抗肿瘤药物、神经系统疾病药物及抗感染药物,具体适应症分布情况请见图41。
(二)附条件批准程序
药物临床试验期间,治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,以及应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的,可基于替代终点、中间临床终点或早期临床试验数据而附条件批准上市。附条件批准上市的目的是缩短药物临床试验的研发时间,使其尽早应用于无法继续等待的危重疾病或公共卫生方面急需的患者。
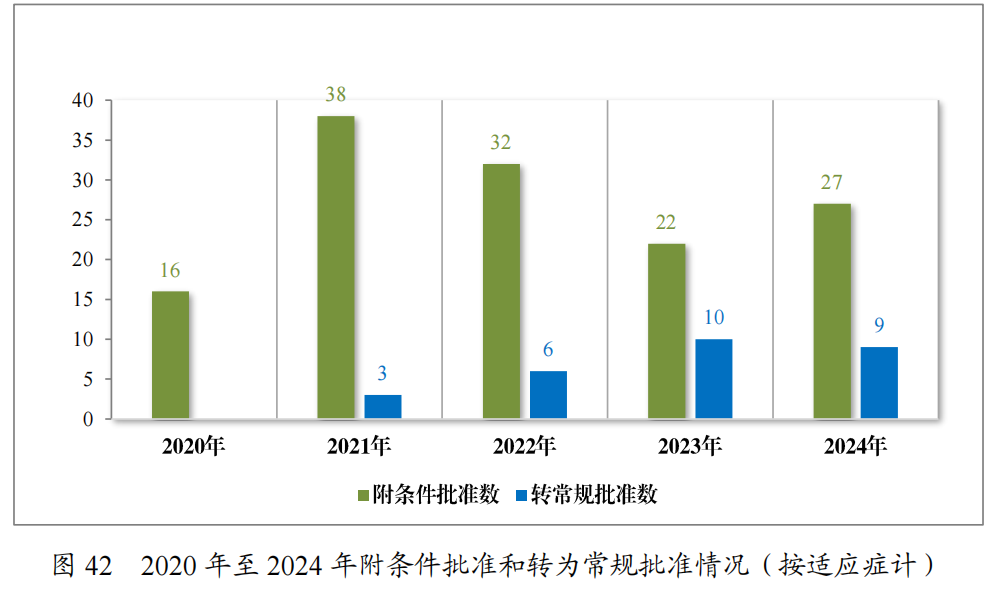
2024年共有37件药品注册申请(27项适应症)附条件批准上市,其中18项适应症为首次批准上市,9项适应症为已上市药品增加适应症(见附件7)。同时,在2024年,共有9项附条件批准的适应症完成确证性研究,转为常规批准。
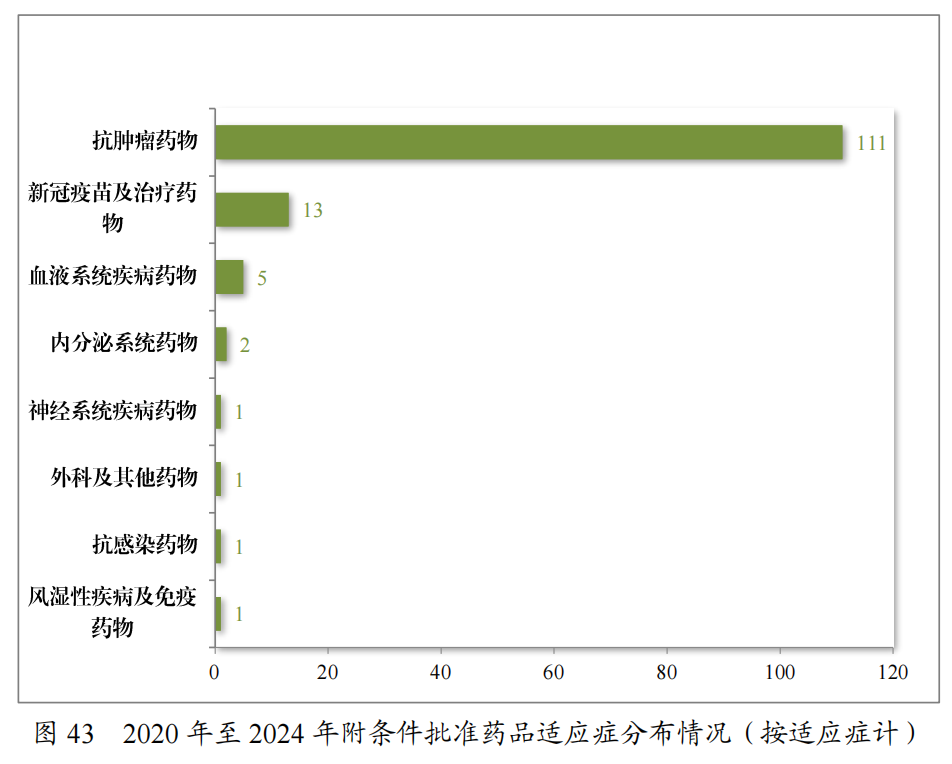
自2020年《药品注册管理办法》(总局第27号令)实施以来,共有187件药品注册申请(135项适应症)附条件批准上市,包括抗肿瘤药物、新冠疫苗及治疗药物、血液系统疾病药物等,其中抗肿瘤药物数量最多,占比82.22%,共有28项附条件批准的适应症完成确证性研究,转为常规批准,具体请见图42、图43。
(三)优先审评审批程序
药品上市许可申请时,对于以下具有明显临床价值的药品,可以申请适用优先审评审批程序:(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;(二)符合儿童生理特征的儿童用药品新品种、剂型和规格;(三)疾病预防、控制急需的疫苗和创新疫苗;(四)纳入突破性治疗药物程序的药品;(五)符合附条件批准的药品;(六)国家药监局规定其他优先审评审批的情形。适用优先审评审批程序的上市注册申请的审评时限由常规程序的200日缩短为130日,其中临床急需境外已上市罕见病用药的审评时限为70日。
2024年共纳入优先审评审批注册申请124件(88个品种),同比增加14.81%,具体纳入情况见图44;2024年按照优先审评审批程序批准110件注册申请(74个品种,其中2个品种新准上市后,同年又批准新适应症)上市,同比增加29.41%。
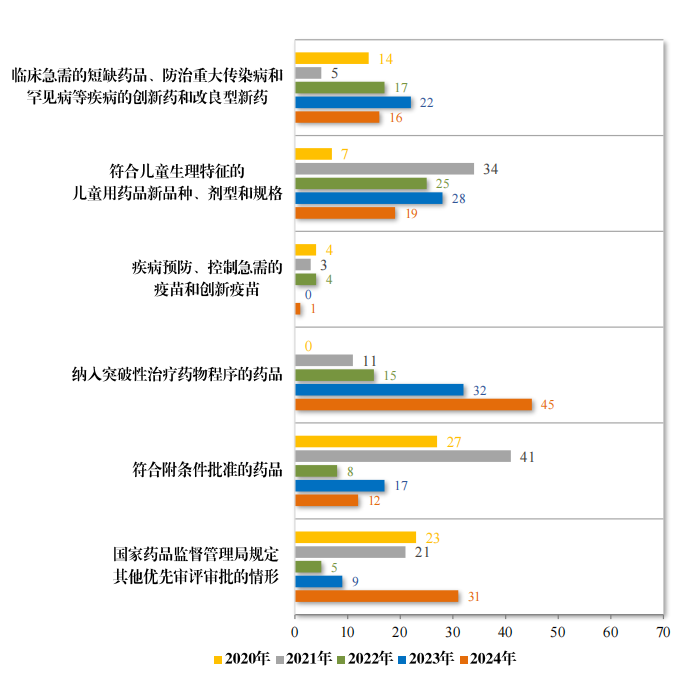
图44 2020年至2024年根据现行《药品注册管理办法》纳入
优先审评审批程序的注册申请情况(件)
自2020年《药品注册管理办法》(总局第27号令)实施以来,共有496件药品注册申请纳入优先审评审批程序,包括抗肿瘤药物、皮肤及五官科药物、内分泌系统药物等,其中抗肿瘤药物数量最多,占比42.54%,具体请见图45。
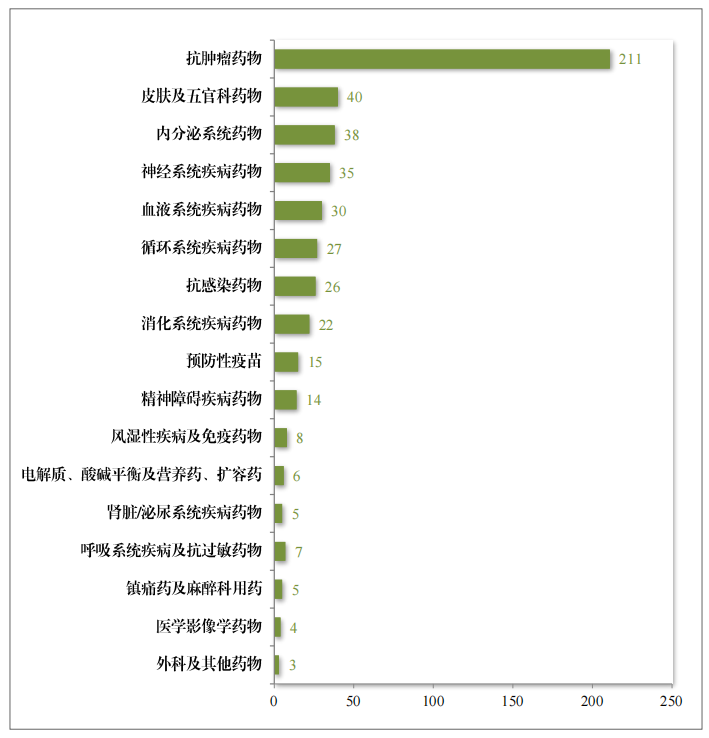
图45 2020年至2024年按现行《药品注册管理办法》纳入优先审评审批程序
品种适应症分布情况
第四章药品研发与审评沟通交流
沟通交流是在药物研发与注册申请过程中,申请人与药审中心就关键技术问题等所进行的沟通交流,是药审中心鼓励药物创新,提高审评审批质效,促进医药产业高质量发展的重要举措之一。
(一)沟通交流会议申请与办理情况
2024年药审中心共接收沟通交流会议申请5554件,办理沟通交流会议申请4912件,为1575家企业的3551个品种(按照申请人提交沟通交流申请时的药品名称计,下同)提供了沟通交流服务,其中召开面对面会议/电话会议691个,同比增加12.91%。2020年至2024年接收及办理沟通交流会议申请情况详见图46。
2024年,药审中心办理沟通交流会议申请4912件,在药物研发关键阶段办理的Ⅱ类会议占比56.05%,其中新药临床试验申请前(Pre-IND)沟通交流会议申请占比20.64%,新药上市许可申请前(Pre-NDA)沟通交流会议申请占比10.36%。2024年沟通交流会议申请接收及办理情况详见表12。
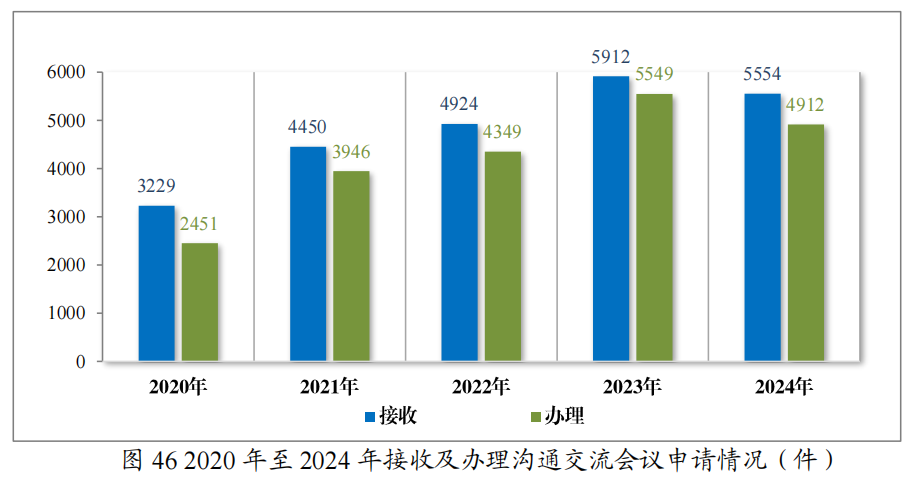
表12 2024年沟通交流会议申请接收及办理情况(件)
|
沟通交流会议申请类型 |
接收量 |
接收占比 |
办理量 |
办理占比 |
|
|
Ⅰ类会议 |
745 |
13.41% |
762 |
15.51% |
|
|
Ⅱ类会议 |
新药临床试验申请前 (Pre-IND) |
1037 |
18.67% |
1014 |
20.64% |
|
新药临床试验申请(IND) |
120 |
2.16% |
138 |
2.81% |
|
|
完成Ⅰ期临床后 (End ofphaseⅠ) |
369 |
6.64% |
359 |
7.31% |
|
|
完成Ⅱ期临床后 (End ofphase Ⅱ) |
674 |
12.14% |
605 |
12.32% |
|
|
新药上市许可申请前 (Pre-NDA) |
540 |
9.72% |
509 |
10.36% |
|
|
新药上市许可申请(NDA) |
88 |
1.58% |
78 |
1.59% |
|
|
其他 |
44 |
0.79% |
50 |
1.02% |
|
|
Ⅲ类会议 |
1937 |
34.88% |
1397 |
28.44% |
|
|
总计 |
5554 |
100.00% |
4912 |
100.00% |
|
(二)一般性技术问题咨询情况
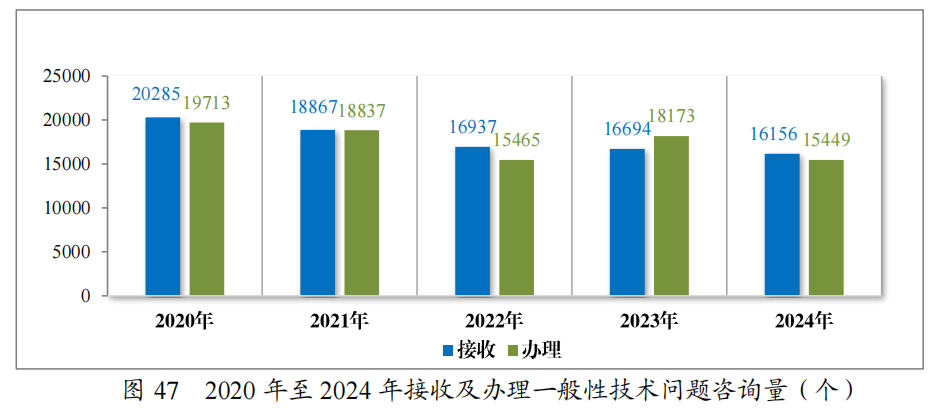
2024年接收一般性技术问题咨询16156个,为3590家企业解答一般性技术问题咨询15449个,及时总结梳理共性问题,并在中心网站予以发布,2024年按程序发布7批共31个常见一般性技术问题解答,涵盖了注册受理、技术审评等方面,累计发布240个共性问题2,2020年至2024年接收及办理一般性技术问题咨询量详见图47。
第五章完善药品技术指导原则体系
(一)制定发布药品技术指导原则
2024年药审中心新发布技术指导原则73个(详见附件8),累计发布技术指导原则达555个3。
1.聚焦国际前沿技术领域,持续完善放射性药物、细胞和基因治疗领域技术评价体系
为鼓励放射性药物的创新研发,参考国外相关指南并结合国内申报情况,制定发布了《氟[18F]化钠注射液仿制药药学研究技术要求(试行)》《放射性化学仿制药药学研究技术指导原则》《放射性治疗药物非临床研究技术指导原则》3个技术指导原则。
为加快完善细胞和基因治疗产品技术评价体系,鼓励探索新技术和新方法,发布了《可复制型慢病毒检测共性问题与技术要求》,在细胞治疗产品领域发布了《细胞治疗产品临床药理学研究技术指导原则(试行)》《间充质干细胞防治移植物抗宿主病临床试验技术指导原则(试行)》《人源干细胞产品非临床研究技术指导原则》《嵌合抗原受体T 细胞治疗血液淋巴系统恶性肿瘤临床试验技术指导原则(试行)》,在基因治疗产品领域发布了《重组腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则》《腺相关病毒载体基因治疗产品非临床研究技术指导原则》。
2.持续丰富符合中药特点的技术标准体系
鼓励以临床价值为导向,围绕临床应用优势和特点进行中药改良型新药研发,发布《中药改良型新药研究技术指导原则(试行)》;探索和丰富“中医药理论、人用经验和临床试验相结合”的注册审评证据体系在具体适应症领域应用的疗效评价标准,发布《中药新药用于紧张型头痛的临床疗效评价技术指导原则(试行)》《小儿便秘中药新药临床研发技术指导原则(试行)》。
贯彻落实《中共中央国务院关于促进中医药传承创新发展的意见》中“支持珍稀濒危中药材替代品的研究和开发利用”的相关要求,
制定发布了《濒危动物类中药材人工制成品研究技术指导原则(试行)》《替代或者减去已上市中药处方中濒危药味研究技术指导原则(试行)》。
为加强中药制剂生产过程质量控制,促进新技术、新方法、新设备在中药生产中的应用,制定发布了《中药口服制剂生产过程质量控制研究技术指导原则(试行)》;完善中药整体质量评价,制定发布了《中药制剂特征图谱研究技术指导原则(试行)》《中药制剂稳定性研究技术指导原则(试行)》;加快推进中药3.1类研发与注册,制定发布了《按古代经典名方目录管理的中药复方制剂药学申报资料撰写指导原则(试行)》。
3. 以问题为导向,持续完善技术标准体系
结合化学药物研发常见共性问题,对《已上市化学药品药学变更研究技术指导原则(试行)》进行补充完善,制定发布了原料药变更的问答;发布了《化学药品注射剂配伍稳定性药学研究技术指导原则(试行)》;完善研发生产主体合规信息管理的长效机制,发布《药品注册研发生产主体合规信息管理与审查指导原则(试行)》。
结合生物制品研发常见问题,制定发布了《抗体偶联药物分段生产试点注册申报技术要求》《抗体偶联药物药学研究与评价技术指导原则》;为加强治疗用重组蛋白产品在研发和生产过程中的质量控制,发布了《治疗用重组蛋白产品临床试验申请病毒清除工艺平台验证技术指导原则(试行)》。进一步完善变更相关技术要求,制定发布了《临床试验期间生物制品药学研究和变更技术指导原则(试行)》《已上市疫苗药学变更研究技术指导原则(试行)》。
持续完善疫苗技术评价体系,制定发布了《疫苗免疫原性桥接临床试验技术指导原则(试行)》《疫苗临床试验统计学指导原则(试行)》《多糖结合疫苗药学研究及评价技术指导原则(试行)》。同时,聚焦具体品种研发特点,制定发布了《脑膜炎球菌疫苗临床试验技术指导原则(试行)》《预防用猴痘疫苗临床试验技术指导原则(试行)》等。
4.加大力度解决特殊群体的用药需求问题,提高药物研发评价体系覆盖率
为优化适合于儿童、吞咽困难等患者群体药物研发,发布了《微型片剂(化学药品)药学研究技术指导原则(试行)》。为生长激素缺乏症创新药临床试验设计提供指导,制定发布了《生长激素制剂用于生长激素缺乏症临床试验技术指导原则》。
紧跟国际监管趋势,制定发布《罕见病基因治疗产品临床试验技术指导原则(试行)》《罕见病酶替代疗法药物非临床研究指导原则(试行)》,及时为罕见病药物研发提供指导。正式引入“去中心化临床试验”理念,发布了《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》,为罕见病药物临床试验提供更加灵活、可及的新方法、新路径。
在具体适应症领域,制定发布了《治疗慢性心力衰竭药物临床试验技术指导原则》《胃食管反流病治疗药物临床试验技术指导原则》《慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则》《抗肿瘤药物说明书安全性信息撰写技术指导原则》等技术指导原则。
5.注重药品研发关键技术要求,助力新药研发提质加速
在共性技术要求方面,发布了《化学药改良型新药临床药理学研究技术指导原则(试行)》《放射性标记人体物质平衡研究技术指导原则》《模型引导的创新药物剂量探索和优化技术指导原则》等,进一步丰富临床药理学评价体系。
参考国际技术要求制定了《基于药代动力学方法支持用于肿瘤治疗的抗PD-1/PD-L1抗体可选给药方案的技术指导原则》《抗肿瘤药物临床试验中SUSAR 分析与处理技术指导原则》《评价胰岛素类药物药代和药效动力学的正葡萄糖钳夹试验指导原则》《药物免疫毒性非临床研究技术指导原则》等,提高企业研发效率。
6.总结仿制药申报共性问题,推动仿制药高质量发展
口服溶液剂作为临床常用的剂型,对于儿童和老年患者具备临床使用方面的优势。为提高此类产品的研发质量,发布了《化学药品仿制药口服溶液剂药学研究技术指导原则》;结合国内外相关指导原则和仿制药研发特点,制定发布《化学仿制药注射剂过量灌装研究技术指导原则》《化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则》《低分子量肝素类仿制药药学研究与评价技术指导原则(试行)》。
7. 完善个药技术指导原则体系
制定了16个生物等效性个药技术指导原则;针对生物制品具体品种发布了《司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则》《地舒单抗注射液生物类似药(肿瘤适应症)临床试验指导原则(试行)》,进行针对性指导。
(二)推动ICH指导原则转化实施
1.国家药监局成功连任新一届ICH管委会成员
国家药监局于2024年6月ICH会议上被推选为新一届ICH管委会成员,此次为国家药监局第三次当选。自2017年加入ICH 以来,国家药监局在新药研发及注册技术标准与国际规则接轨方面,取得了长足进步。截至2024年12月,国家药监局已采纳实施了当前全部71个ICH指导原则。根据2024年监管科学创新中心(Centrefor Innovation in RegulatoryScience,CIRS)调查结果,国家药监局实施和遵循ICH指导原则的情况较2021年相比成效显著,与欧美日等其他国际监管机构成员实施和遵循的程度趋同。
药审中心建立完善ICH议题协调和实施工作机制,研究制定ICH指导原则实施时间表和路线图,在充分听取工业界和学界意见的基础上,2024年共报国家药监局发布6个ICH指导原则适用公告,包括《Q14:分析方法开发》《M12:药物相互作用》《E11A:儿科外推》等7个ICH指导原则,进一步推动药品注册技术要求全面与国际接轨,实现药品注册技术标准统一、规则统一。
此外,国家药监局ICH代表分别参加了2024年ICH里斯本、福冈和蒙特利尔会议,深度参与国际监管规则的制定,及时跟进议题内容的技术交流与探讨,适时分享中国药品监管经验,获得国际各方肯定。截至2024年12月,国家药监局共向45个ICH协调议题工作组选派了具有丰富专业背景经验的专家79人,共计参与ICH 日常工作电话会议593次。
2.促进监管机构和工业界互动多样化
为进一步促进工业界在审评注册工作实践中对ICH 指导原则的准确理解,截至2024年12月,ICH工作办公室共组织举办ICH指导原则专家研讨会14场和宣贯培训3场,并在DIA欧洲年会、ICH展望会、国际生物医药产业创新北京论坛等平台参与了ICH 专题活动,一方面积极宣传了中国ICH工作进展,另一方面对外传递出与国际良好监管实践保持一致的积极开放态度。通过组织多种形式的对话交流,监管机构和工业界聚焦ICH 指导原则在中国落地实施过程中面临的问题或挑战,围绕具体案例进行讨论,促进彼此之间的理解,进而构筑共识,更好促进ICH指导原则的实施和遵循。
第六章药品监管科学研究
药审中心聚焦国际药品监管前沿技术,结合国家科技发展战略要求,依托药品监管科学全国重点实验室、“中国药品监管科学行动计划”平台,组织实施了38项药品监管科学研究,过程中与产学研监等相关方持续互动交流,开展了22次公开宣讲,发表了12篇学术论文,固化新的监管理念,形成25个技术指导原则,9篇调研报告,将新科学引入药品审评过程,协助解决临床和监管急需问题,推动新技术转化应用和产业高质量发展。
(一)研究项目
药审中心本年度组织实施的药品监管科学研究主要分为以下四类:
1.指导药物研发新技术应用
细胞和基因治疗产品、小核酸药物、mRNA疫苗、多糖结合疫苗、人用疫苗新型佐剂技术、放射性药物、皮肤外用、鼻用、眼用等局部起效半固体化学制剂等。
2.助力药物研发新工具的应用
人工智能技术临床研发应用、数字健康技术在去中心化临床试验的应用、真实世界证据应用、模型引导的药物研发、以患者为中心的药物研发、疫苗平台技术、类器官/器官芯片、新颖临床试验设计等。
3.满足临床需求和疾病治疗
四大慢性疾病、重大突发新发传染病、神经系统疾病、血液系统疾病、特殊人群用药、抗多重耐药细菌药物等
4.完善科学监管工具
推动eCTD的实施、智能化临床试验风险预测及分析等。
(二)合作与沟通
药审中心持续强化协同创新,完善合作机制,凝聚行业顶尖研究力量,与28家产学研监机构合作开展前沿技术研究以及重大创新项目的研审联动,促进创新成果转化。
1.整合优势资源,共同推动特殊人群药物研发和转化
药审中心定位老年人群重大疾病领域,围绕科技重大专项支持的创新药品,建立了前沿成果加速转化和应用的协同创新合作平台,集聚6家国家老年医学中心/国家老年疾病临床医学研究中心,3家高校科研机构优势力量,联合攻关,探索可用于表征参加临床试验的老年人群的生理、心理和社会状况的工具,用最合适的人群产出科学可靠的试验数据,并用以支持在老年人群中进行药物获益-风险评估。结合老年人群特点在创新药研发中开展适老化设计,开发出更适合老年人使用的药物。后续在相关技术标准起草过程中,持续与学术界、产业界和患者组织进行交流,传递并完善相关研发和监管理念。
2.跨领域合作推动新技术发展和转化应用
药审中心积极探索类器官和器官芯片等仿生模型技术在研发中的应用与评价方法,与6家高校科研机构合作建立肝、肠、心脏、肿瘤模型等类器官或器官芯片方法,开展类器官或器官芯片方法学验证,建立评价类器官、器官芯片生理生化及功能的标准认证和监管技术标准,鼓励使用高性价比平台提高研发效率。
3.在药品监管科学研究中引入患者声音
药审中心成立专项课题组,开展“重点疾病领域以患者为中心药物研发和评价技术标准”研究,与患者组织代表、研发企业、临床研究者代表等多方共同研讨,听取各方意见,分析“以患者为中心”药物研发现状、面临的挑战及下一步努力方向。在此基础上,课题组就重大慢病领域中神经退行性疾病、自身免疫性疾病、罕见病等患者感受和体验数据等进行了深入研究,用于药品技术标准体系建设,以支持相关领域创新药物的科学研发和监管决策。同时,将研究成果作为ICH 专家工作组参与ICH新议题《E22:患者偏好研究的一般考虑》协调的重要考量。
4.积极探索战略层面“研审联动”机制
药审中心与行业顶尖研究机构建立持久的学术合作关系,共同开展药品监管科学研究,以适应日新月异的科学技术发展,更好地利用新技术指导监管决策,从而促进创新产品转化,服务国家科技发展战略。目前,已与广州国家实验室建立合作关系,推动开展新型疫苗研发平台技术确认及评价体系、重大呼吸慢病新药研发的关键技术等项目研究,探索解决研发共性问题,推动创新成果转化,并以此为蓝本,持续扩展对外合作,强化监管科学研究合力。
(三)研究成果与转化
1.鼓励和支持源头创新,“中国制药”含金量不断提升
为鼓励和支持新药研发,药审中心自2019年实施药品监管科学研究以来,先后聚焦细胞和基因治疗产品、新型疫苗、小核酸药物、放射性药物等领域探索建立新工具、新标准。在细胞和基因治疗领域,先后研究起草发布30余个技术指导原则,其中本年度研究起草细胞和基因治疗产品申报沟通交流、临床试验设计、体内过程评价、临床获益-风险评价等8个技术指导原则。
我国已有多款小核酸药物获批临床,药审中心正在加快推进小核酸药物监管科学项目研究,尽快研究起草相关技术指导原则,助力我国小核酸药物创新实现突破。
2.满足临床急需,按下惠及患者“加速键”
药审中心开展了mRNA疫苗、多糖结合疫苗、多联疫苗、人用疫苗新型佐剂技术等领域评价标准研究,2021 年以来先后研究起草了15个药品技术指导原则,将WHO、ICH等监管理念、先进的分析方法及分析工具引入我国疫苗监管考虑中,补齐我国疫苗监管短板,满足我国计划免疫亟需加强的临床需求。其中,本年度发布了多糖结合疫苗药学技术评价指导原则,推动了7个多糖结合疫苗进入临床,对12个多糖结合疫苗进行临床前技术指导,其中涉及多个高价次迭代疫苗,如24价、26价肺炎球菌多糖结合疫苗等。本年度药审中心研究起草了预防用mRNA疫苗非临床研究技术指导原则,提高国际标准制定的参与度,提升我国mRNA疫苗研发自主率。另外,药审中心研究起草了专门针对疫苗佐剂的非临床研究技术指导原则,弥补监管短板,促进相关产品研发进程,已批准10个含新型佐剂的疫苗开展临床试验,正在推进2个含新型佐剂疫苗的上市审评审批,疫苗种类包括流感病毒疫苗、呼吸道合胞病毒疫苗、带状疱疹疫苗、狂犬病疫苗、结核病疫苗、新型冠状病毒疫苗等。
聚焦临床急需和产品监管需要,药审中心通过开展系列监管科学项目研究,研究起草了阿尔茨海默病治疗药物、慢性丁型肝炎病毒感染治疗药物、抗菌药物、罕见病药物、老年人群治疗药物等相关技术指导原则。
药审中心建立了阿尔茨海默病治疗产品技术评价标准,推动相关产品通过优先审评程序在我国与国外监管机构同步批准上市,近两年共批准8款1类或2.4类新药开展临床试验。
药审中心结合近年丁肝治疗新药及乙肝功能性治愈新药的新进展,参考学术界和业界对新药临床试验设计的技术考量,与科研院所、疾控机构合作,探索实现数据互通互享,相关研究成果数据及时指导新药临床试验设计,发布了《慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则》,对受试人群、主要终点、试验周期等提出了更为清晰具体的、可实操的技术建议。
3.促进中药传承创新发展
大力发展中药监管科学,将研究成果转化为19个相关技术指导原则。本年度研究起草6个,包括中药口服制剂生产过程质量控制研究、中药制剂稳定性研究、古代经典名方中药复方制剂研究等评价标准。推动8个按古代经典名方目录管理的中药复方制剂(即中药3.1类)研发上市,加快12个品种研发进程。
第七章药品研发与技术审评宣贯与培训
2024年,药审中心围绕申请人关注的热点难点问题,以线上线下相结合方式构建多元化宣贯形式,助力提升医药产业研发水平。
按照2024年全国药品监督管理工作会议部署,为进一步完善与申请人的沟通交流服务机制,加强对申请人的服务,加大对药品注册相关政策和技术要求的宣贯力度,2024年药审中心开设了“药审云课堂”,于每月第1个周五下午定期在线举办,就申请人关心的常见共性问题进行交流,及时对新发布的药品注册相关政策或技术要求进行宣贯。2024年共举办12期,15万余人在线观看(含回看数据),培训议题涉及71个,包括申报资料撰写要点与受理常见问题解析、创新药临床研发技术考虑、各类药品审评常见问题解析等;同时聚焦补充申请试点、推动仿制药高质量研发、鼓励创新等中心重点工作开展专题解读,具体清单详见附件9。
推出“药审云课堂平台”,对2024年开展的71门课程重新整理并细化分类,观看界面友好便捷,同步开设直播入口、课程中心、提问和互动等模块,帮助申请人更加全面、透彻地掌握相关技术要求和监管考虑。
同时,药审中心赴东北地区、京津冀地区、成渝地区、长三角地区、粤港澳大湾区以线下形式开展药品注册技术系列培训班10场,涉及14个培训专题,内容覆盖中药、化学药、生物制品药物研发共性问题与申报常见问题交流,以及化学药自评估报告、放射性药物研发、儿童用药等热点专题,共计8000余人参训,针对性解决区域内企业药品研发中存在的痛点难点问题,加快产品研发申报进程,助力区域医药产业高质量发展。
第八章2024年度药品审评主要工作回顾
(一)2024年1月5 日,国家药监局发布关于适用《M7(R2):评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险》国际人用药品注册技术协调会指导原则的公告,自2024年1月3 日开始的相关研究(以试验记录时间点为准),均适用M7(R2)指导原则正文、问答及附录。
(二)2024年1月24 日,药审中心发布《国家药监局药审中心关于定期举办“药审云课堂”的通知》,定于每月第1个周五下午定期在线举办“药审云课堂”,就申请人关心的常见共性问题进行交流,及时对新发布的药品注册相关政策或技术要求进行宣贯。
(三)2024年2月7 日,国家药监局发布《优化药品补充申请审评审批程序改革试点工作方案》,在有能力、有条件的省级药品监管部门开展试点工作,试点省级药品监管部门按照“提前介入、一企一策、全程指导、研审联动”的原则,为辖区内药品重大变更申报前提供前置指导、核查、检验和立卷服务,大幅缩短需要核查检验补充申请的技术审评用时。
(四)2024年2月7 日,药审中心发布《药物研发与技术审评沟通交流会议申请资料参考》,分别制定了中药、化学药品、生物制品的药物研发与技术审评沟通交流会议申请资料参考,供注册申请人准备沟通交流会议申请资料时参考。
(五)2024年4月17 日,药审中心发布《药审中心关于已上市药品说明书增加儿童用药信息工作细则(试行)》,明确《已上市药品说明书增加儿童用药信息工作程序(试行)》中品种遴选范围、说明书修订与审核流程,以及品种申报程序等相关配套文件的要求。
(六)2024年4月23 日,国家药监局发布《关于优化已在境内上市的境外生产药品转移至境内生产的药品上市注册申请相关事项的公告》,为进一步优化外商投资环境,促进医药行业高质量发展,公告提出简化申报资料要求,实施优先审评审批等鼓励措施。
(七)2024年5月9 日,药审中心发布《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)》,明确了进口化学药品转移至境内生产的具体申报要求。
(八)2024 年5 月22日,国家药监局发布关于适用《Q5A(R2):来源于人或动物细胞系生物技术产品的病毒安全性评价》国际人用药品注册技术协调会指导原则的公告,规定自2025年5月21日开始的相关研究(以试验记录时间点为准),均适用Q5A(R2)指导原则。
(九)2024年5月28日,国家药监局发布关于适用《Q2(R2):分析方法验证》《Q14:分析方法开发》国际人用药品注册技术协调会指导原则的公告,规定自2024年11月24 日开始的相关研究(以试验记录时间点为准),均适用Q2(R2)/Q14指导原则。
(十)2024年5月31 日,药审中心网站“儿童用药专栏”开始持续公示优先审评审批的儿童用药批准信息,使研发单位更好地了解与把握儿童用药创新研发方向。
(十一)2024年6月4 日,国家药监局第三次当选ICH管委会成员,表明我国在新药研发及注册技术标准方面与国际规则接轨,药品监管国际化进程方面得到国际认可。
(十二)2024年6月14 日,药审中心发布《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)》,明确了进口治疗用生物制品转移至境内生产的具体申报要求。
(十三)2024年6月25 日,国家药监局发布关于适用《Q3C(R9):杂质:残留溶剂的指导原则》国际人用药品注册技术协调会指导原则的公告,规定自2024年6月20 日起开始的相关研究(以试验记录时间点为准),均适用Q3C(R9)指导原则。
(十四)2024年7月1 日,为贯彻落实《国务院办公厅关于全面加强药品监管能力建设的实施意见》有关要求,提升“互联网+药品监管”应用服务水平,药审中心建立了电子申报资料网络传输通道,在使用光盘提交电子申报资料的基础上,增加网络传输方式,为申请人提交电子申报资料提供多种选择,以提升申请人电子申报资料提交效率。
(十五)2024年7月31 日,国家药监局发布《优化创新药临床试验审评审批试点工作方案》,进一步优化临床试验审评审批机制,实现30 日内完成创新药临床试验审评审批,大幅缩短药物临床试验启动用时。
(十六)2024年9月13 日,药审中心发布《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》,指导和帮助研发单位在罕见疾病药物研发全程充分倾听患者声音,推动以患者为中心的罕见疾病药物研发和上市。
(十七)2024年10月22 日,国家药监局发布《生物制品分段生产试点工作方案》,探索部分创新生物制品、临床急需生物制品的分段生产,推动生物医药产业优化资源配置,有序融入国际产业链,促进产业高质量发展。2024年11月7 日,药审中心关于发布《抗体偶联药物分段生产试点注册申报技术要求》。
(十八)2024年10月23 日,药审中心发布《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(预防用生物制品)》,明确了进口预防用生物制品转移至境内生产的具体申报要求。
(十九)2024年11月1 日起,药审中心对创新药以及经沟通交流确认可纳入优先审评审批程序和附条件批准程序的品种上市许可申请提供受理靠前服务。上市许可申请递交前,申请人可就受理相关问题向药审中心、药品长三角分中心、药品大湾区分中心提出受理靠前服务申请。
(二十)2024年11月1日,国家药监局发布关于适用《M12:药物相互作用研究》国际人用药品注册技术协调会指导原则及问答文件的公告,规定自2024年10月29 日起开始的相关研究(以试验记录时间点为准),均适用M12指导原则及问答文件。
(二十一)2024年11月19日,国家药监局发布关于适用《E11A:儿科外推》国际人用药品注册技术协调会指导原则的公告,规定自2024年11月18 日起开始的相关研究(以试验记录时间点为准),均适用E11A指导原则。
(二十二)2024年11月22 日,国家药监局发布同意北京等十省(市)开展优化药品补充申请审评审批程序改革试点的批复意见,加快推进补充申请试点工作进展。
结语
征程万里风正劲,重任千钧再扬帆。2025年是“十四五”规划收官之年,也是落实全面深化药品监管改革各项举措的关键一年,药审中心将在国家药监局党组的坚强领导下,深入学习贯彻党的二十大和二十届二中、三中全会精神,以钉钉子精神抓好《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》的贯彻落实,推进优化药品补充申请审评审批程序等改革试点工作,加大对研发创新的支持力度,加强药品注册申报前置指导,加快临床急需药品审评审批,推动审评技术要求与国际接轨,支持开展国际多中心临床试验,促进全球药物在中国同步研发、同步申报、同步审批、同步上市,完善中药审评审批体系,聚焦医药创新前沿领域发展药品监管科学,加快开发和应用监管新工具、新标准、新方法,推进药品审评审批信息化建设,加强审评审批人才队伍建设,切实保障人民群众用药安全有效,为推进中国式现代化贡献药审力量。
附件1 2024年国家药监局批准的创新药
2024年国家药监局批准的创新药
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
1 |
脯氨酸加格 列净片 |
惠升生物制药股份有限公司 |
化学药品 |
内分泌系统药物 |
本品适用于改善成人2型糖尿病患者的血糖控制。单药治疗:本品配合饮食控制和运动,用于改善成人2型糖尿病患者的血糖控制。 与盐酸二甲双胍联合使用:当单独使用盐酸二甲双胍仍不能有效控制血糖时,本品可与盐酸二甲双胍联合使用,在饮食和运动基础上改善成人2型糖尿病患者的血糖控制。 用药限制:本品不适用于1型糖尿病或糖尿病酮症酸中毒。 |
|
|
2 |
富马酸泰吉 利定注射液 |
江苏恒瑞医药股份有限公司 |
化学药品 |
镇痛药及 麻醉科用 药 |
本品适用于治疗腹部手术后中重度疼痛。 |
|
|
3 |
妥拉美替尼 胶囊 |
上海科州药物研发有限公司 |
化学药品 |
抗肿瘤药 物 |
本品适用于含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。 |
附条件批准程 序、优先审评 审批程序 |
|
4 |
富马酸安奈 克替尼胶囊 |
正大天晴药业集团股份有限公司 |
化学药品 |
抗肿瘤药 物 |
本品适用于ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。 |
|
|
5 |
恩替司他片 |
泰州亿腾景昂药业股份有限公司 |
化学药品 |
抗肿瘤药 物 |
本品联合芳香化酶抑制剂用于治疗激素受体 (HR)阳性、人类表皮生长因子受体-2(HER- 2)阴性,经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
6 |
盐酸伊普可 泮胶囊 |
NovartisPharmaSchweiz AG |
化学药品 |
血液系统 疾病药物 |
本品适用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。 |
突破性治疗药物程序、优先审评审批程序 |
|
7 |
瑞普替尼胶 囊 |
Bristol-MyersSquibb Company |
化学药品 |
抗肿瘤药 物 |
本品适用于ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。 |
突破性治疗药物程序、附条件批准程序、 优先审评审批程序 |
|
8 |
注射用舒巴 坦钠/注射用 度洛巴坦钠 组合包装 |
Entasis Therapeutics Inc. |
化学药品 |
抗感染药 物 |
本品用于治疗18岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎 (VABP)。 本品不适用于治疗鲍曼- 醋酸钙不动杆菌复合体敏感分离株以外病原体所致 HABP/VABP(见【临床试验】)。 为减少耐药菌形成,维持本品和其它抗菌药物的有效性,本品仅用于治疗已证实或强烈疑似由敏感细菌引起的感染。当可获得培养及药敏信息,选择或调整抗菌治疗时应予以考虑。如缺少此类数据,根据经验进行治疗选择时可参考当地流行病学和药敏性特征信息。 |
优先审评审批程序 |
|
9 |
枸橼酸依奉阿克胶囊 |
正大天晴药业集团股份有限公司 |
化学药品 |
抗肿瘤药 物 |
本品单药适用于未经过间变性淋巴瘤激酶 (ALK)抑制剂治疗的ALK阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
10 |
甲磺酸瑞厄替尼片 |
南京圣和药业股份有限公司 |
化学药品 |
抗肿瘤药 物 |
本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。 |
|
|
11 |
考格列汀片 |
海思科医药集团股份有限公司 |
化学药品 |
内分泌系统药物 |
本品适用于改善成人2型糖尿病患者的血糖控制。单药治疗:本品单药可配合饮食控制和运动,用于改善成人2型糖尿病患者的血糖控制。 与盐酸二甲双胍联合治疗:当单独使用盐酸二甲双胍仍不能有效控制血糖时,本品可与盐酸二甲双胍联合使用,在饮食和运动基础上改善成人2型糖尿病患者的血糖控制。 重要的使用限制:本品不适用于1型糖尿病或糖尿病酮症酸中毒的患者。 |
|
|
12 |
戈利昔替尼 胶囊 |
迪哲(江苏)医药股份有限公司 |
化学药品 |
抗肿瘤药 物 |
单药适用于既往至少接受过一线系统性治疗的复发或难治的外周T细胞淋巴瘤(r/r PTCL)成人患 者。 |
附条件批准程 序、优先审评 审批程序 |
|
13 |
枸橼酸倍维 巴肽注射液 |
百奥泰生物制药股份有限公司 |
化学药品 |
循环系统 疾病药物 |
用于进行经皮冠状动脉介入术(包括进行冠状动脉内支架置入术)的急性冠脉综合征患者,以降低急性闭塞、支架内血栓、无复流和慢血流发生的风 险。 |
|
|
14 |
苯甲酸福格 列汀片 |
深圳信立泰药业股份有限公司 |
化学药品 |
内分泌系统药物 |
本品适用于改善成人2型糖尿病患者的血糖控制。单药治疗:本品单药可配合饮食控制和运动,用于改善成人2型糖尿病患者的血糖控制。 与盐酸二甲双胍联合治疗:当单独使用盐酸二甲双 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
胍仍不能有效控制血糖时,本品可与盐酸二甲双胍联合使用,在饮食和运动基础上改善成人2型糖尿病患者的血糖控制。 重要的使用限制:本品不适用于1型糖尿病或糖尿病酮症酸中毒的患者。 |
||||||
|
15 |
氟泽雷塞片 |
信达生物科技有限公司 |
化学药品 |
抗肿瘤药 物 |
本品适用于至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。 |
突破性治疗药物程序、附条件批准程序、 优先审评审批程序 |
|
16 |
甲磺酸普雷福韦片 |
西安葛蓝新通制药有限公司 |
化学药品 |
抗感染药 物 |
本品适用于慢性乙型肝炎成人患者的治疗。 |
|
|
17 |
格索雷塞片 |
上海正大天晴医 药科技开发有限 公司 |
化学药品 |
抗肿瘤药 物 |
本品适用于治疗至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。 |
突破性治疗药物程序、附条件批准程序、 优先审评审批程序 |
|
18 |
盐酸佐利替 尼片 |
江苏晨泰医药科技有限公司 |
化学药品 |
抗肿瘤药 物 |
本品适用于具有表皮生长因子受体(EGFR)19号外显子缺失或外显子21(L858R)置换突变,并伴中枢神经系统(CNS)转移的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。 |
|
|
19 |
戊二酸利那 拉生酯胶囊 |
上海生诺医药科技有限公司 |
化学药品 |
消化系统 疾病药物 |
反流性食管炎。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
20 |
磷酸森格列 汀片 |
盛世泰科生物医药技术(苏州)股份有限公司 |
化学药品 |
内分泌系统药物 |
本品适用于改善成人2型糖尿病患者的血糖控制。单药治疗:本品单药可配合饮食控制和运动,用于改善成人2型糖尿病患者的血糖控制。 与盐酸二甲双胍联合治疗:当单独使用盐酸二甲双胍仍不能有效控制血糖时,本品可与盐酸二甲双胍联合使用,在饮食和运动基础上改善成人2型糖尿病患者的血糖控制。 重要的使用限制:本品不适用于1型糖尿病或糖尿病酮症酸中毒的患者。 |
|
|
21 |
苯磺酸克利 加巴林胶囊 |
海思科医药集团股份有限公司 |
化学药品 |
神经系统 疾病药物 |
本品用于治疗成人糖尿病性周围神经理疼痛和带状疱疹后神经痛。 |
|
|
22 |
甲磺酸瑞齐替尼胶囊 |
上海倍而达药业 有限公司 |
化学药品 |
抗肿瘤药 物 |
本品适用于:具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的局部晚期或复发转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。 既往经EGFR酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M 突变阳性的局部晚期或转移性NSCLC成人患者的治疗。 |
|
|
23 |
己二酸他雷替尼胶囊 |
葆元生物医药科 技(杭州)有限 公司 |
化学药品 |
抗肿瘤药 物 |
本品用于经ROS1-TKI治疗后进展的ROS1阳性局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。 |
突破性治疗药物程序、附条件批准程序、 优先审评审批程序 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
24 |
仑卡奈单抗 注射液 |
EisaiInc. |
治疗用生物制品 |
神经系统 疾病药物 |
本品用于治疗由阿尔茨海默病引起的轻度认知障碍和阿尔茨海默病轻度痴呆。 |
优先审评审批程序 |
|
25 |
可伐利单抗注射液 |
Roche Pharma(Schweiz) AG |
治疗用生物制品 |
血液系统 疾病药物 |
本品适用于未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症成人和青少年(≥12岁)患者。 |
突破性治疗药物程序、优先审评审批程序 |
|
26 |
泽沃基奥仑赛注射液 |
恺兴生命科技 (上海)有限公 司 |
治疗用生物制品 |
抗肿瘤药 物 |
用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。 |
突破性治疗药物程序、附条件批准程序、 优先审评审批程序 |
|
27 |
依沃西单抗 注射液 |
康方赛诺医药有限公司 |
治疗用生物制品 |
抗肿瘤药 物 |
本品联合培美曲塞和卡铂,用于经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗后进展的EGFR基因突变阳性的局部晚期或转移性非 鳞状非小细胞肺癌(NSCLC)患者的治疗。 |
突破性治疗药物程序、优先审评审批程序 |
|
28 |
泽美洛韦玛 佐瑞韦单抗 注射液 |
兴盟生物医药 (苏州)有限公 司 |
治疗用生物制品 |
抗感染药 物 |
用于成人狂犬病病毒暴露者的被动免疫。本品适用于III级狂犬病病毒暴露者及按照III级狂犬病病毒暴露处置者的被动免疫,应联合使用狂犬病疫苗。 |
|
|
29 |
依柯胰岛素 注射液 |
NovoNordisk A/S |
治疗用生物制品 |
内分泌系统药物 |
用于治疗成人2型糖尿病。 |
|
|
30 |
恩朗苏拜单抗注射液 |
石药集团巨石生物制药有限公司 |
治疗用生物制品 |
抗肿瘤药 物 |
适用于既往接受含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)的复发或转移性宫颈癌患者。 |
附条件批准程序 |
|
31 |
西达基奥仑赛注射液 |
南京传奇生物科技有限公司 |
治疗用生物制品 |
抗肿瘤药 物 |
本品用于治疗复发或难治性多发性骨髓瘤成人患 者,既往接受过至少三线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。 |
突破性治疗药物程序、附条件批准程序、 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
优先审评审批程序 |
||||||
|
32 |
赛立奇单抗 注射液 |
重庆智翔金泰生 物制药股份有限 公司 |
治疗用生物制品 |
皮肤及五 官科药物 |
本品用于治疗适合系统治疗或光疗的中度至重度斑块状银屑病成人患者。 |
|
|
33 |
司普奇拜单抗注射液 |
成都康诺行生物 医药科技有限公 司 |
治疗用生物制品 |
皮肤及五 官科药物 |
本品用于治疗外用药控制不佳或不适合外用药治疗的成人中重度特应性皮炎。 |
突破性治疗药物程序、优先审评审批程序 |
|
34 |
伊努西单抗 注射液 |
康融东方(广 东)医药有限公 司 |
治疗用生物制品 |
循环系统 疾病药物 |
在控制饮食的基础上,与他汀类药物、或者与他汀类药物及其他降脂疗法联合用药,用于在接受中等剂量或中等以上剂量他汀类药物治疗后,仍无法达到低密度脂蛋白胆固醇(LDL-C)目标的原发性高胆固醇血症(包括杂合子型家族性和非家族性高胆固醇血症)和混合型血脂异常的成人患者,以降低低密度脂蛋白胆固醇(LDL-C)、总胆固醇 (TC)、载脂蛋白B(ApoB)水平。 |
|
|
35 |
艾帕洛利托 沃瑞利单抗注射液 |
齐鲁制药有限公司 |
治疗用生物制品 |
抗肿瘤药 物 |
本品适用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。 |
附条件批准程序 |
|
36 |
昂戈瑞西单抗注射液 |
上海君实生物医 药科技股份有限 公司 |
治疗用生物制品 |
循环系统 疾病药物 |
在控制饮食的基础上,与他汀类药物、或者与他汀类药物和依折麦布联合用药,用于在接受中等剂量或中等剂量以上他汀类药物治疗,仍无法达到低密度脂蛋白胆固醇(LDL-C)目标的原发性高胆固醇血症(非家族性)和混合型血脂异常的成人患者, |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
以降低低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、载脂蛋白B(ApoB)水平。 |
||||||
|
37 |
注射用芦康 沙妥珠单抗 |
四川科伦博泰生 物医药股份有限 公司 |
治疗用生物制品 |
抗肿瘤药 物 |
本品用于既往至少接受过2种系统治疗(其中至少1种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。 |
突破性治疗药物程序、优先审评审批程序 |
|
38 |
贝莫苏拜单抗注射液 |
正大天晴药业集团南京顺欣制药 有限公司 |
治疗用生物制品 |
抗肿瘤药 物 |
1.本品联合盐酸安罗替尼胶囊、卡铂和依托泊苷用于广泛期小细胞肺癌(ES-SCLC)患者的一线治 疗。2.本品联合盐酸安罗替尼胶囊,用于既往系统性抗肿瘤治疗后失败且不适合进行根治性手术治疗或根治性放疗的非微卫星高度不稳定(非MSI- H)或非错配修复基因缺陷(非dMMR)的复发性或转移性子宫内膜癌的治疗。 |
突破性治疗药 物程序、附条 件批准程序、 优先审评审批 程序(仅针对 第2项适应 症) |
|
39 |
夫那奇珠单抗注射液 |
苏州盛迪亚生物医药有限公司 |
治疗用生物制品 |
皮肤及五 官科药物 |
用于治疗适合接受系统治疗或光疗的中重度斑块状银屑病的成人患者。 |
|
|
40 |
悬铃木花粉 变应原皮肤 点刺液 |
浙江我武生物科技股份有限公司 |
治疗用生物制品 |
呼吸系统 疾病及抗 过敏药物 |
用于皮肤点刺试验,辅助诊断与悬铃木花粉致敏相关的I型变态反应性疾病。 |
|
|
41 |
德国小蠊变 应原皮肤点 刺液 |
浙江我武生物科技股份有限公司 |
治疗用生物制品 |
呼吸系统 疾病及抗 过敏药物 |
用于皮肤点刺试验,辅助诊断与德国小蠊致敏相关的I型变态反应性疾病。 |
|
|
42 |
猫毛皮屑变 应原皮肤点 刺液 |
浙江我武生物科技股份有限公司 |
治疗用生物制品 |
呼吸系统 疾病及抗 过敏药物 |
用于皮肤点刺试验,辅助诊断与猫毛皮屑致敏相关的I型变态反应性疾病。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
治疗领域 |
适应症 |
加快上市程序 |
|
43 |
多奈单抗注 射液 |
Eli Lillyand Company |
治疗用生物制品 |
神经系统 疾病药物 |
本品用于治疗由阿尔茨海默病引起的轻度认知障碍和阿尔茨海默病轻度痴呆。 |
突破性治疗药物程序、优先审评审批程序 |
|
44 |
塔戈利单抗 注射液 |
四川科伦博泰生 物医药股份有限 公司 |
治疗用生物制品 |
抗肿瘤药 物 |
本品单药用于既往接受过二线及以上化疗失败的复发或转移性鼻咽癌患者的治疗。 |
|
|
45 |
注射用佐妥 昔单抗 |
Astellas PharmaEurope B.V. |
治疗用生物制品 |
抗肿瘤药 物 |
本品联合含氟尿嘧啶类和铂类药物化疗用于 CLDN18.2阳性、人表皮生长因子受体2(HER2)阴性的局部晚期不可切除或转移性胃或胃食管交界处(GEJ)腺癌患者的一线治疗。 |
|
|
46 |
儿茶上清丸 |
湖北齐进药业有限公司 |
中药 |
五官 |
清热退火,解毒敛疮,止痛。用于轻型复发性阿弗他溃疡上焦实热证。症见:口舌生疮,溃疡疼痛,口渴欲饮,口粘口臭,舌质红,舌苔黄或黄腻,脉弦洪或弦数。 |
|
|
47 |
九味止咳口 服液 |
卓和药业集团股份有限公司 |
中药 |
呼吸 |
宣肺止咳。用于急性气管-支气管炎中医辨证属风热证的咳嗽,伴见咳痰、咽干,舌红苔薄黄、脉浮数或浮滑。 |
|
|
48 |
秦威颗粒 |
成都华西天然药物有限公司 |
中药 |
风湿免疫 |
清热除湿祛风,活血通络止痛。用于急性痛风性关节炎风湿郁热证,症见关节疼痛、关节肿胀、关节局部发热、口渴喜饮,舌质红、苔黄、脉滑数。 |
附件2 2024年通过优先审评审批程序批准的罕见病用药
2024年通过优先审评审批程序批准的罕见病用药
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
1 |
伯瑞替尼肠溶胶囊 |
北京浦润奥生物 科技有限责任公 司 |
化学药品 |
1 |
非小细胞肺癌 本品用于治疗具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌患者。 本适应症是基于一项单臂临床试验的结果给予的附条件批准。本适应症的完全批准将取决于后续开展的确证性临床试验的临床获益。 脑胶质瘤 既往治疗失败的具有PTPRZ1-MET融合基因的IDH突变型星形细胞瘤(WHO 4级)或有低级别病史的胶质母细胞瘤成人患者。 |
|
2 |
妥拉美替尼胶囊 |
上海科州药物股份有限公司 |
化学药品 |
1 |
本品适用于含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。本品为基于替代终点获得附条件批准上市,暂未获得临床终点数据,有效性和安全性尚待上市后进一步确证。 |
|
3 |
盐酸伊普可泮胶囊 |
NovartisPharmaSchweiz AG |
化学药品 |
1 |
本品适用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。 |
|
4 |
苯乙酸钠苯 甲酸钠注射用浓溶液 |
安徽沃泰生物医药有限公司 |
化学药品 |
3 |
用于急性高氨血症及尿素循环障碍引起的儿童及成人的相关脑病的治疗。 在急性高氨血症发作期间,应考虑补充精氨酸和热量、限制饮食蛋白质、血液透析和其他降氨疗法。 |
|
5 |
二氮嗪口服混悬液 |
宿州亿帆药业有限公司 |
化学药品 |
3 |
用于治疗先天性高胰岛素性低血糖血症。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
6 |
奥德昔巴特胶囊 |
Ipsen Pharma |
化学药品 |
5.1 |
用于治疗≥6月龄的进行性家族性肝内胆汁淤积症(PFIC)患者的瘙痒。 使用限制:本品可能对携带特定ABCB11变体而导致胆盐输出泵蛋白(BSEP-3)无功能或完全缺失的PFIC 2型患者亚组无效。 |
|
7 |
醋酸氟氢可的松片 |
ASPEN PHARMATRADING LIMITED |
化学药品 |
5.1 |
适用于失盐型先天性肾上腺皮质增生症(CAH)和失盐型原发性慢性肾上腺皮质功能减退症(Addison病)。 |
|
8 |
醋酸锌片 |
NobelpharmaCo.,Ltd. |
化学药品 |
5.1 |
用于治疗肝豆状核变性。 |
|
9 |
伐莫洛龙口服混悬液 |
Santhera Pharmaceuticals (Deutschland)GmbH |
化学药品 |
5.1 |
适用于4岁及以上杜氏肌营养不良(DMD)患者的治疗。 |
|
10 |
加那索龙口服混悬剂 |
Marinus Pharmaceuticals,Inc. |
化学药品 |
5.1 |
适用于2岁及以上细胞周期蛋白依赖性激酶5(CDKL5)缺乏症(CDD)患者癫痫发作的治疗。 |
|
11 |
盐酸替洛利生片 |
Bioprojet Pharma |
化学药品 |
5.1 |
用于治疗发作性睡病青少年和6岁及以上儿童患者的日间过度嗜睡(EDS)或猝倒。 |
|
12 |
盐酸曲恩汀胶囊 |
MSN LaboratoriesPrivate Limited |
化学药品 |
5.2 |
用于治疗青霉胺不耐受的肝豆状核变性。 |
|
13 |
盐酸曲恩汀胶囊 |
NavintaLLC |
化学药品 |
5.2 |
用于治疗青霉胺不耐受的肝豆状核变性。 |
|
14 |
可伐利单抗注射液 |
RochePharma (Schweiz) AG |
治疗用生物制品 |
1 |
本品适用于未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症成人和青少年(≥12岁)患者。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
15 |
艾加莫德α 注射液(皮下注射) |
argenx BV |
治疗用生物制品 |
2.2 |
本品适用于治疗以下患者: • 与常规治疗药物联合用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。 •慢性炎性脱髓鞘性多发性神经根神经病(CIDP)成人患者。 |
|
16 |
注射用伏尼凝血素α |
Takeda PharmaceuticalsU.S.A., Inc. |
治疗用生物制品 |
3.1 |
本品适用于诊断为血管性血友病(VWD)的成人患者(年龄为18岁及以上): •按需治疗和出血事件的控制; • 围手术期出血管理。 |
|
17 |
注射用利纳西普 |
Kiniksa Pharmaceuticals(UK),Ltd. |
治疗用生物制品 |
3.1 |
冷吡啉相关周期性综合征(CAPS) 成人和12岁及以上青少年冷吡啉相关周期性综合征(CAPS), 包括家族性寒冷性自身炎症综合征(FCAS)、Muckle-Wells综合征(MWS)。 复发性心包炎(RP) 成人和12岁及以上青少年复发性心包炎(RP)并降低复发风险。 |
|
18 |
注射用培妥 罗凝血素α |
Novo Nordisk A/S |
治疗用生物制品 |
3.1 |
本品适用于12岁及以上的血友病A(先天性凝血因子Ⅷ缺乏)患者: •按需治疗及控制出血事件 • 围手术期管理 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
• 常规预防治疗以防止或减少出血事件的发生 •本品不适用于治疗血管性血友病(von Willebranddisease,vWD)。 |
|||||
|
19 |
注射用舒索凝血素α |
Takeda PharmaceuticalsU.S.A., Inc |
治疗用生物制品 |
3.1 |
本品适用于获得性血友病A成人患者按需治疗和出血事件的控制。 尚未确定本品在基线抗猪凝血因子VIII抑制物滴度大于20Bethesda单位(BU)的患者中的安全性和疗效。 |
|
20 |
佩索利单抗 注射液(皮下注射) |
BoehringerIngelheim InternationalGmbH |
治疗用生物制品 |
2.2;2.1 |
本品适用于减少12岁及以上青少年(体重≥40 kg)和成人的泛发性脓疱型银屑病(GPP)发作。 |
附件3 2024年通过优先审评审批程序批准的儿童用药
2024年通过优先审评审批程序批准的儿童用药
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
1 |
本维莫德乳膏 |
上海泽德曼医药科技有限公司 |
化学药品 |
2.4 |
本品用于2岁及以上轻中度特应性皮炎患者的局部外用治疗。 |
|
2 |
艾曲泊帕乙醇胺 干混悬剂 |
山东则正医药技术 有限公司 |
化学药品 |
3 |
本品适用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的成人和6岁及以上儿童慢性免疫性(特发性)血小板减少症(ITP)患者,使血小板计数升高并减少或防止出血。本品仅用于因血小板减少和临床条件导致出血风险增加的ITP患者。 |
|
3 |
苯乙酸钠苯甲酸钠注射用浓溶液 |
安徽沃泰生物医药 有限公司 |
化学药品 |
3 |
用于急性高氨血症及尿素循环障碍引起的儿童及成人的相关脑病的治疗。在急性高氨血症发作期间,应考虑补充精氨酸和热量、限制饮食蛋白质、血液透析和其他降氨疗 法。 |
|
4 |
对乙酰氨基酚栓 |
浙江尔婴药品有限公司 |
化学药品 |
3 |
用于儿童普通感冒或流行性感冒引起的发热,也用于缓解轻至中度疼痛如头痛、关节痛、偏头痛、牙痛、肌肉痛、神经痛。 |
|
5 |
二氮嗪口服混悬液 |
宿州亿帆药业有限公司 |
化学药品 |
3 |
用于治疗先天性高胰岛素性低血糖血症。 |
|
6 |
磷酸二氢钠磷酸氢二钠颗粒 |
嘉实(湖南)医药科技有限公司 |
化学药品 |
3 |
治疗低磷血症,用于低血磷性佝偻病/骨软化症患者。 |
|
7 |
硫酸阿托品滴眼液 |
沈阳兴齐眼药股份 有限公司 |
化学药品 |
3 |
本品用于延缓球镜度数为-1.00D至-4.00D(散光≤1.50D、屈光参差≤1.50D)的6至12岁儿童的近视进展。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
8 |
盐酸万古霉素胶囊 |
时森海(杭州)医药科技有限公司 |
化学药品 |
3 |
本品适用于治疗成人及18岁以下儿童患者:(1)艰难梭菌相关性腹泻;(2)由金黄色葡萄球菌(包括甲氧西林耐药菌株)引起的小肠结肠炎。 使用限制 •静脉注射万古霉素对上述感染无效,因此对于上述感染,必须口服盐酸万古霉素。 • 口服盐酸万古霉素对其他类型感染无效。 为了减少耐药细菌的产生,保持万古霉素和其他抗菌药物的有效性,万古霉素应仅用于治疗已证实或强烈怀疑由敏感细菌引起的感染。在选择或调整抗菌药物治疗方案时,应考虑细菌培养和药敏试验结果。如果没有这些试验的数据做参考,则应当根据当地流行病学和病原菌敏感性进行经验性治疗。 |
|
9 |
阿布昔替尼片 |
Pfizer Inc. |
化学药品 |
5.1 |
本品适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和12岁及以上青少年患者。 |
|
10 |
奥德昔巴特胶囊 |
Ipsen Pharma |
化学药品 |
5.1 |
用于治疗≥6月龄的进行性家族性肝内胆汁淤积症(PFIC)患者的瘙痒。 使用限制:本品可能对携带特定ABCB11变体而导致胆盐输出泵蛋白(BSEP-3)无功能或完全缺失的PFIC 2型患者亚组无效。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
11 |
醋酸氟氢可的松片 |
ASPEN PHARMATRADING LIMITED |
化学药品 |
5.1 |
适用于失盐型先天性肾上腺皮质增生症(CAH)和失盐型原发性慢性肾上腺皮质功能减退症(Addison病)。 |
|
12 |
醋酸锌片 |
Nobelpharma Co.,Ltd. |
化学药品 |
5.1 |
用于治疗肝豆状核变性。 |
|
13 |
恩曲替尼胶囊 |
Roche Pharma(Schweiz) AG |
化学药品 |
5.1 |
实体瘤: 本品适用于符合下列条件的成人和1月龄以上儿童实体瘤患者, - 经充分验证的检测方法诊断为携带神经营养酪氨酸受体激酶(NTRK)融合基因且不包括已知获得性耐药突变, - 患有局部晚期、转移性疾病或手术切除可能导致严重并发症的患者,以及 - 无满意替代治疗或既往治疗失败的患者。 本适应症为基于替代终点获得附条件批准上市,暂未获得临床终点数据,有效性和安全性尚待上市后进一步确证。 非小细胞肺癌(NSCLC): 本品适用于ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。 |
|
14 |
伐莫洛龙口服混悬液 |
Santhera Pharmaceuticals (Deutschland) GmbH |
化学药品 |
5.1 |
适用于4岁及以上杜氏肌营养不良(DMD)患者的治疗。 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册分类 |
适应症 |
|
15 |
加那索龙口服混悬剂 |
Marinus Pharmaceuticals, Inc. |
化学药品 |
5.1 |
适用于2岁及以上细胞周期蛋白依赖性激酶5(CDKL5)缺乏症(CDD)患者癫痫发作的治疗。 |
|
16 |
盐酸米诺环素泡沫剂 |
Journey MedicalCorporation |
化学药品 |
5.1 |
本品适用于9岁及以上儿童和成人患者的非结节性中度至重度寻常痤疮炎症性病变的局部治疗。 |
|
17 |
盐酸替洛利生片 |
Bioprojet Pharma |
化学药品 |
5.1 |
用于治疗发作性睡病成人、青少年和6岁及以上儿童患者的日间过度嗜睡(EDS)或猝倒。 |
|
18 |
聚乙二醇重组人生长激素注射液 |
长春金赛药业有限责任公司 |
治疗用生物制品 |
2.2 |
用于性腺发育不全(特纳综合征)所致女孩的生长障碍。 |
|
19 |
注射用利纳西普 |
Kiniksa Pharmaceuticals (UK), Ltd. |
治疗用生物制品 |
3.1 |
冷吡啉相关周期性综合征(CAPS): 成人和12岁及以上青少年冷吡啉相关周期性综合征(CAPS),包括家族性寒冷性自身炎症综合征 (FCAS)、Muckle-Wells综合征(MWS)。 复发性心包炎(RP): 成人和12岁及以上青少年复发性心包炎(RP)并降低复发风险。 |
|
20 |
注射用培妥罗凝血素α |
Novo Nordisk A/S |
治疗用生物制品 |
3.1 |
本品适用于12岁及以上的血友病A(先天性凝血因子Ⅷ缺乏)患者: • 按需治疗及控制出血事件 •围手术期管理 • 常规预防治疗以防止或减少出血事件的发生 • 本品不适用于治疗血管性血友病(von Willebranddisease,vWD)。 |
附件4 2024年国家药监局批准的境外已上市境内未上市的药品
2024年国家药监局批准的境外已上市境内未上市的药品
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
1 |
阿地溴铵 吸入粉雾 剂 |
Covis Pharma Europe B.V. |
化学药品 |
5.1 |
本品适用于成人慢性阻塞性肺疾病(COPD)患者的维持治疗以缓解症状。 |
首次批准上 市 |
|
2 |
阿伐可泮胶囊 |
Vifor Fresenius Medical Care Renal Pharma France |
化学药品 |
5.1 |
适用于成人严重、活动性抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(肉芽肿性多血管炎[GPA]或显微镜下多血管炎 [MPA])在含糖皮质激素的标准治疗下的辅助治疗。本品不能消除糖皮质激素的使用。 |
首次批准上 市 |
|
3 |
奥德昔巴特胶囊 |
Ipsen Pharma |
化学药品 |
5.1 |
用于治疗≥6月龄的进行性家族性肝内胆汁淤积症(PFIC)患者的瘙痒。 使用限制:本品可能对携带特定ABCB11变体而导致胆盐输出泵蛋白(BSEP-3)无功能或完全缺失的PFIC 2型患者亚组无效。 |
首次批准上 市 |
|
4 |
贝组替凡 片 |
MERCK SHARP& DOHME (UK) LIMITED |
化学药品 |
5.1 |
不需要立即手术的von Hippel-Lindau(VHL)病相关肾细胞癌 (RCC)、中枢神经系统(CNS)血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)成人患者 |
首次批准上 市 |
|
5 |
倍氯米松 福莫特罗 吸入粉雾 剂 |
Chiesi Farmaceutici S.p.A. |
化学药品 |
5.1 |
本品适用于哮喘规律治疗,本品联合用药形式(吸入性糖皮质激素+长效β2受体激动剂)适用于以下情况: - 使用吸入性糖皮质激素和“按需”使用短效β2受体激动剂未获良好控制的患者; - 使用吸入性糖皮质激素和长效β2受体激动剂已获得控制的患 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
者。 本品适用于成人患者。 |
||||||
|
6 |
苯磺酸美 洛加巴林 片 |
DAIICHI SANKYO CO., LTD. |
化学药品 |
5.1 |
本品用于治疗成人糖尿病性周围神经病理性疼痛 |
首次批准上 市 |
|
7 |
玻璃酸钠滴眼液 |
URSAPHARM Arzneimittel GmbH |
化学药品 |
5.1 |
用于中重度及持久性干眼症患者眼球表面的润滑,缓解干眼症状。 |
首次批准上 市 |
|
8 |
泊那替尼 片 |
Otsuka Pharmaceutical Co., Ltd. |
化学药品 |
5.1 |
本品适用于治疗以下疾病:对一代和二代酪氨酸激酶抑制剂耐药和/或不耐受的慢性髓细胞白血病慢性期成人患者;无其他酪氨酸激酶抑制剂适用的复发或难治性慢性髓细胞白血病加速期或急变期,以及费城染色体阳性急性淋巴细胞白血病成人患者;任何酪氨酸激酶抑制剂耐药,并采用经充分验证的检测方法诊断为伴有T315I 突变的慢性髓细胞白血病(慢性期、加速期和急变期)或费城染色体阳性急性淋巴细胞白血病成人患者;使用限 制:不适用于且不建议用于新诊断的慢性期(CP)慢性髓性白血病(CML)患者。 |
首次批准上 市 |
|
9 |
布地奈德 福莫特罗 吸入气雾剂(III) |
AstraZeneca Pharmaceuticals LP |
化学药品 |
5.1 |
用于慢性阻塞性肺疾病(COPD)患者的维持治疗。本品不适用于缓解急性支气管痉挛或治疗哮喘 |
首次批准上 市 |
|
10 |
布瑞哌唑 片 |
Otsuka Pharmaceutical Co.,Ltd. |
化学药品 |
5.1 |
本品用于治疗成人精神分裂症。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
11 |
雌二醇地 屈孕酮片 |
Abbott B.V. |
化学药品 |
5.1 |
本品为激素替代治疗(HRT)药物,适用于治疗绝经后至少12个月的女性的雌激素缺乏症状。 本品在65岁以上女性中的治疗经验有限。 |
首次批准上 市 |
|
12 |
醋酸氟氢 可的松片 |
ASPEN PHARMATRADING LIMITED |
化学药品 |
5.1 |
适用于失盐型先天性肾上腺皮质增生症(CAH)和失盐型原发性慢性肾上腺皮质功能减退症(Addison病)。 |
首次批准上 市 |
|
13 |
醋酸锌片 |
NobelpharmaCo.,Ltd |
化学药品 |
5.1 |
治疗肝豆状核变性 |
首次批准上 市 |
|
14 |
多替诺雷 片 |
FUJI YAKUHIN CO., LTD. |
化学药品 |
5.1 |
适用于痛风伴高尿酸血症患者。 |
首次批准上 市 |
|
15 |
伐莫洛龙 口服混悬 液 |
Santhera Pharmaceuticals (Deutschland) GmbH |
化学药品 |
5.1 |
适用于4岁及以上杜氏肌营养不良(DMD)患者的治疗。 |
首次批准上 市 |
|
16 |
高血糖素 鼻用粉雾 剂 |
Amphastar Pharmaceuticals, Inc. |
化学药品 |
5.1 |
本品适用于治疗4岁及以上的成人及儿科糖尿病患者的严重低血糖。 |
首次批准上 市 |
|
17 |
灌注用盐 酸氨酮戊酸己酯 |
Photocure ASA |
化学药品 |
5.1 |
本品是一种光学成像剂,用于膀胱癌(包括原位癌)患者的膀胱镜检查,包括既往的膀胱镜检查结果为疑似或已确诊的膀胱癌,或者随访期需要膀胱镜检查的患者。 本品联合蓝光膀胱镜作为白光膀胱镜的辅助检查。 |
首次批准上 市 |
|
18 |
加那索龙 口服混悬 剂 |
Marinus Pharmaceuticals, Inc. |
化学药品 |
5.1 |
适用于2岁及以上细胞周期蛋白依赖性激酶5(CDKL5)缺乏症(CDD)患者癫痫发作的治疗。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
19 |
甲磺酸沙非胺片 |
ZambonS.p.A. |
化学药品 |
5.1 |
本品适用于原发性帕金森病伴症状波动(包括剂末恶化和开-关现象)成人患者的联合治疗(与左旋多巴合用,或与左旋多巴及其他帕金森病药物合用)。 |
首次批准上 市 |
|
20 |
酒石酸伐 尼克兰鼻喷雾剂 |
Oyster Point Pharma, Inc. |
化学药品 |
5.1 |
本品适用于增加干眼患者的泪液分泌。 |
首次批准上 市 |
|
21 |
来那帕韦钠片 |
ileadSciences Ireland UC |
化学药品 |
5.1 |
与其他抗反转录病毒药物联合使用,用于治疗当前方案无法达到病毒学抑制的多重耐药1型人类免疫缺陷病毒(HIV-1)感染的成人患者。 本品为来那帕韦钠注射液的注射前口服导入用药。 |
首次批准上 市 |
|
22 |
来那帕韦 钠注射液 |
ileadSciences Ireland UC |
化学药品 |
5.1 |
本品适用于与其他抗反转录病毒药物联合使用,用于治疗当前方案无法达到病毒学抑制的多重耐药1型人类免疫缺陷病毒 (HIV-1)感染的成人患者。 |
首次批准上 市 |
|
23 |
利多卡因 凝胶贴膏 |
Teikoku Pharma USA, Inc. |
化学药品 |
5.1 |
用于缓解带状疱疹后神经痛,用于无破损皮肤。 |
首次批准上 市 |
|
24 |
磷酸奥唑司他片 |
Recordati Rare Diseases |
化学药品 |
5.1 |
本品适用于治疗成人的库欣综合征[皮质醇增多症]。 |
首次批准上 市 |
|
25 |
硫酸瑞美 吉泮口崩 片 |
Pfizer Inc. |
化学药品 |
5.1 |
本品适用于成人有或无先兆偏头痛的急性治疗。 |
首次批准上 市 |
|
26 |
马来酸阿 可替尼片 |
AstraZeneca Pty Ltd |
化学药品 |
5.1 |
既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
27 |
玛伐凯泰胶囊 |
Bristol-MyersSquibbAustralia Pty Ltd |
化学药品 |
5.1 |
本品用于治疗纽约心脏协会(NYHA)心功能分级II-III级的梗阻性肥厚型心肌病(HCM)成人患者,以改善运动能力和症 状。 |
首次批准上 市 |
|
28 |
匹妥布替尼片 |
Eli Lilly Nederland B.V. |
化学药品 |
5.1 |
本品单药适用于既往接受过至少两种系统性治疗(含布鲁顿氏酪氨酸激酶[BTK]抑制剂)的复发或难治性套细胞淋巴瘤(MCL)成人患者。 |
首次批准上 市 |
|
29 |
普托马尼 片 |
Mylan Ireland Limited |
化学药品 |
5.1 |
治疗对异烟肼、利福霉素类、任意一种氟喹诺酮类药物和任意一种二线抗结核药物注射剂均耐药的成人肺结核(TB)患者,或者对异烟肼和利福平耐药且对标准治疗不耐受或无应答的成人肺结核(TB)患者 |
首次批准上 市 |
|
30 |
氢溴酸吡 西替尼片 |
AstellasPharmaInc. |
化学药品 |
5.1 |
适用于对甲氨蝶呤疗效不佳或耐受的中度至重活动性类风湿关节炎成人患者。 使用本品前,应至少使用过一种传统合成DMARDs药物治疗。 |
首次批准上 市 |
|
31 |
替尔泊肽注射液 |
Eli Lilly andCompany |
化学药品 |
5.1 |
本品适用于成人2型糖尿病患者的血糖控制: 在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病患者。 |
首次批准上 市 |
|
32 |
托夫生注 射液 |
Biogen MA Inc. |
化学药品 |
5.1 |
本品用于治疗携带超氧化物歧化酶1(SOD1)基因突变的肌萎缩侧索硬化(ALS)成人患者。 |
首次批准上 市 |
|
33 |
熊去氧胆 酸口服混 悬液 |
Dr. Falk PharmaGmbH |
化学药品 |
5.1 |
1.胆囊胆固醇结石-必须是X射线能穿透的结石,同时胆囊收缩功能须正常。 2.胆汁淤积性肝病(如:原发性胆汁性肝硬化)。 3.胆汁反流性胃炎。 4.1月龄至18岁患者的囊性纤维化相关肝病。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
34 |
亚甲蓝肠 溶缓释片 |
AlfasigmaS.p.A. |
化学药品 |
5.1 |
本品作为一种诊断剂,适用于在接受结肠镜检查筛查或监测的成人患者中增强结直肠病变的可视化。 |
首次批准上 市 |
|
35 |
盐酸氨溴 索喷雾剂 |
GMep MedicalTechnology GmbH |
化学药品 |
5.1 |
适用于6岁以上儿童及成人的痰液粘稠及排痰困难。 |
首次批准上 市 |
|
36 |
盐酸卡马替尼片 |
NovartisPharmaSchweiz AG |
化学药品 |
5.1 |
用于未经系统治疗的携带间质上皮转化因子(MET)外显子14跳跃突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者 |
首次批准上 市 |
|
37 |
盐酸米诺 环素泡沫 剂 |
Journey MedicalCorporation |
化学药品 |
5.1 |
本品适用于9岁及以上儿童和成人患者的非结节性中度至重度寻常痤疮炎症性病变的局部治疗。 |
首次批准上 市 |
|
38 |
依伏卡塞 片 |
Kyowa Kirin Co.,Ltd. |
化学药品 |
5.1 |
本品用于治疗维持性透析患者的继发性甲状旁腺功能亢进症。 |
首次批准上 市 |
|
39 |
鱼油 (3%) 橄榄油中 /长链脂 肪乳/氨基酸 (16)/葡萄糖(13%)注射液 |
Fresenius Kabi AB |
化学药品 |
5.1 |
当口服或肠内营养无法进行、不足或有禁忌时,本品为成人患者和2岁及2岁以上的儿童患者提供肠外营养。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
40 |
鱼油 (3%) 橄榄油中 /长链脂 肪乳/氨基酸 (16)/葡萄糖(42%)注射液 |
Fresenius Kabi AB |
化学药品 |
5.1 |
当口服或肠内营养无法进行、不足或有禁忌时,本品为成人患者和2岁及2岁以上的儿童患者提供肠外营养。 |
首次批准上 市 |
|
41 |
注射用芦比替定 |
PharmaMar AG |
化学药品 |
5.1 |
附条件批准注册,用于治疗含铂化疗中或化疗后疾病进展的转移性小细胞肺癌(SCLC)成人患者。生产工艺、质量标准、说明书和标签按所附执行。 |
首次批准上 市 |
|
42 |
注射用尼可地尔 |
Chugai Pharmaceutical Co.,Ltd. |
化学药品 |
5.1 |
不稳定型心绞痛。 |
首次批准上 市 |
|
43 |
注射用亚胺西瑞 |
Merck Sharp& Dohme B.V. |
化学药品 |
5.1 |
本品适用于治疗18岁及以上患者由敏感革兰阴性菌引起的下列感染: 医院获得性细菌性肺炎和呼吸机相关性细菌性肺炎(HABP/VABP) 本品适用于治疗由以下微生物引起的医院获得性细菌性肺炎和呼吸机相关性细菌性肺炎(HABP/VABP):醋酸钙-鲍曼不动杆菌复合体、阴沟肠杆菌、大肠埃希菌、流感嗜血杆菌、产气克雷伯菌、产酸克雷伯菌、肺炎克雷伯菌、铜绿假单胞菌和粘质沙雷 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
菌。
治疗药物选择有限或无替代治疗的复杂性尿路感染(cUTI)(包括肾盂肾炎) 本品适用于治疗由以下微生物引起的治疗药物选择有限或无替代治疗的复杂性尿路感染(cUTI)(包括肾盂肾炎):阴沟肠杆 菌、大肠埃希菌、产气克雷伯菌、肺炎克雷伯菌和铜绿假单胞菌。 该适应症的批准是基于本品有限的临床安全性和有效性数据。
治疗药物选择有限或无替代治疗的复杂性腹腔内感染(cIAI) 本品适用于由以下微生物引起的治疗药物选择有限或无替代治疗的复杂性腹腔内感染(cIAI):粪拟杆菌、脆弱拟杆菌、卵形类杆菌、粪便拟杆菌、多形拟杆菌、单形拟杆菌、普通拟杆菌、弗氏柠檬酸杆菌、阴沟肠杆菌、大肠埃希菌、具核梭杆菌、产气克雷伯菌、产酸克雷伯菌、肺炎克雷伯菌、狄氏副拟杆菌和铜绿假单胞菌。 该适应症的批准是基于本品有限的临床安全性和有效性数据。
为减少细菌耐药的产生,并维持本品和其他抗菌药物的疗效,本品应仅用于治疗已经证实或者高度怀疑由敏感细菌引起的感染。如果有细菌培养和药敏的相关信息,应在选择或调整抗菌疗法时 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
予以考虑。如果缺少这类信息,则可参考当地流行病学和药敏情况选择经验性治疗。 |
||||||
|
44 |
紫杉醇口服溶液 |
DAEHWA PHARMACEUTICAL CO.,LTD. |
化学药品 |
5.1 |
本品适用于一线含氟尿嘧啶类方案治疗期间或治疗后出现疾病进展的晚期胃癌患者。 |
首次批准上 市 |
|
45 |
阿布昔替尼片 |
Pfizer Inc. |
化学药品 |
5.1 |
本品适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和12岁及以上青少年患者。 |
增加适应症 |
|
46 |
奥拉帕利 片 |
AstraZeneca AB |
化学药品 |
5.1 |
适用于接受过新辅助或辅助化疗的携带有害或疑似有害胚系 BRCA突变(gBRCAm)、人表皮生长因子受体2(HER2)阴性早期高风险乳腺癌成人患者的辅助治疗。 |
增加适应症 |
|
47 |
吡仑帕奈 片 |
Eisai Europe Limited |
化学药品 |
5.1 |
成人和12岁及以上儿童癫痫原发性全面性强直-阵挛发作患者的加用治疗。 |
增加适应症 |
|
48 |
醋酸奥曲 肽注射液 |
NovartisPharmaSchweiz AG |
化学药品 |
5.1 |
先天性高胰岛素血症相关低血糖(当二氮嗪治疗无效或不耐受时) |
增加适应症 |
|
49 |
醋酸兰瑞 肽缓释注 射液(预充式) |
IPSEN PHARMA |
化学药品 |
5.1 |
用于不可切除、高分化或中分化、局部晚期或转移性胃肠胰神经内分泌瘤(GEP-NETs)的成人患者,以改善无进展生存期;用于类癌综合征成人患者;使用时,可减少短效生长抑素类似物应急治疗的频率 |
增加适应症 |
|
50 |
恩曲替尼胶囊 |
Roche Pharma (Schweiz) AG |
化学药品 |
5.1 |
同意本品附条件批准,扩展适应症人群,用于符合下列条件的成人和1月龄以上儿童实体瘤患者:经充分验证的检测方法诊断为携带神经营养酪氨酸受体激酶(NTRK)融合基因且不包括已知 |
增加适应症 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
获得性耐药突变,患有局部晚期、转移性疾病或手术切除可能导致严重并发症的患者,以及无满意替代治疗或既往治疗失败的患者。 |
||||||
|
51 |
恩扎卢胺软胶囊 |
Astellas PharmaEurope B.V. |
化学药品 |
5.1 |
转移性激素敏感性前列腺癌(mHSPC)成年患者 |
增加适应症 |
|
52 |
二十碳五 烯酸乙酯软胶囊 |
Amarin Pharmaceuticals Ireland Ltd. |
化学药品 |
5.1 |
与他汀类药物联合使用,用于确诊心血管疾病或糖尿病伴≥2种其他心血管疾病危险因素,合并高甘油三酯血症(≥150 mg/dL)的成年患者,以降低心血管事件风险(心肌梗死、卒中、冠状动脉血运重建和不稳定型心绞痛需住院治疗)。 |
增加适应症 |
|
53 |
甲氨蝶呤注射液 |
medac Gesellschaftfürklinische Spezialpräparate mbH |
化学药品 |
5.1 |
用于成人活动性类风湿关节炎 |
增加适应症 |
|
54 |
卡替拉韦钠片 |
ViiV Healthcare BV |
化学药品 |
5.1 |
本品适用于有感染风险的成人和青少年(体重≥35kg)用于 HIV-1短期暴露前预防(PrEP),以降低性传播感染HIV-1的风险。在开始使用本品用于HIV-1PrEP之前,个体的HIV-1检测结果必须为阴性。本品可用作:口服导入剂,以在卡替拉韦注射液给药前评估耐受性。口服PrEP,适用于卡替拉韦注射液计划剂量遗漏的情况下作为短期PrEP口服用药。 |
增加适应症 |
|
55 |
卡替拉韦注射液 |
ViiV Healthcare BV |
化学药品 |
5.1 |
本品适用于有感染风险的成人和青少年(体重≥35kg)进行 HIV-1暴露前预防(PrEP),以降低性传播感染HIV-1的风险(见【用法用量】、【禁忌】、【注意事项】)。结合安全的性行为措施以达到更好的HIV-1PrEP效果。在开始使用本品(伴 |
增加适应症 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
或不伴口服导入卡替拉韦钠片给药)用于HIV-1PrEP之前,个体的HIV-1检测结果必须为阴性。 |
||||||
|
56 |
磷酸芦可替尼片 |
NovartisEuropharmLimited |
化学药品 |
5.1 |
1、骨髓纤维化 用于中危或高危的原发性骨髓纤维化(PMF)(亦称为慢性特发性骨髓纤维化)、真性红细胞增多症继发的骨髓纤维化(PPV-MF)或原发性血小板增多症继发的骨髓纤维化(PET-MF)的成年患者,治疗疾病相关脾肿大或疾病相关症状。 2、移植物抗宿主病 用于治疗对糖皮质激素或其他系统治疗应答不充分的12岁及以上急性移植物抗宿主病(急性GVHD)或慢性移植物抗宿主病(慢性GVHD)患者。 |
增加适应症 |
|
57 |
马来酸阿 伐曲泊帕 片 |
AkaRx Inc. |
化学药品 |
5.1 |
本品适用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,使血小板计数升高并减少或防止出血。本品仅用于因血小板减少和临床条件导致出血风险增加的ITP患者。 |
增加适应症 |
|
58 |
塞利尼索 片 |
Karyopharm Therapeutics Inc. |
化学药品 |
5.1 |
本品单药适用于既往接受过至少两线系统性治疗的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者。 |
增加适应症 |
|
59 |
盐酸替洛利生片 |
Bioprojet Pharma |
化学药品 |
5.1 |
用于治疗发作性睡病青少年和6岁及以上儿童患者的日间过度嗜睡(EDS)或猝倒。 |
增加适应症 |
|
60 |
九价人乳 头瘤病毒 疫苗(酿 酒酵母) |
Merck Sharp& Dohme LLC |
预防用生物 制品 |
3.1 |
在9~14岁女性人群中增加2剂免疫程序 |
增加免疫程 序 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
61 |
四价人乳 头瘤病毒 疫苗(酿 酒酵母) |
Merck Sharp& Dohme LLC |
预防用生物 制品 |
3.1 |
在9~13岁女性人群中增加2剂免疫程序。 |
增加免疫程 序 |
|
62 |
艾加莫德 α注射液 (皮下注射) |
argenx BV |
治疗用生物 制品 |
3.1 |
本品与常规治疗药物联合用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。 |
首次批准上 市 |
|
63 |
本瑞利珠 单抗注射 液 |
AstraZeneca AB |
治疗用生物 制品 |
3.1 |
用于成人和12岁及以上青少年重度嗜酸粒细胞性哮喘(SEA)的维持治疗。 |
首次批准上 市 |
|
64 |
加卡奈珠 单抗注射 液 |
Eli Lilly Nederland B.V. |
治疗用生物 制品 |
3.1 |
适用于成人偏头痛的预防性治疗。 |
首次批准上 市 |
|
65 |
利妥昔单 抗注射液 (皮下注 射) |
Roche Pharma (Schweiz) AG |
治疗用生物 制品 |
3.1 |
本品适用于:非霍奇金淋巴瘤:先前未经治疗的CD20阳性Ⅲ-Ⅳ期滤泡性非霍奇金淋巴瘤患者,应与化疗联合使用。初治滤泡性淋巴瘤患者经本品联合化疗后达完全或部分缓解后的单药维持治疗。复发或化疗耐药的滤泡性淋巴瘤。CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、多柔比星、长春新碱、泼尼松)8个周期联合治疗。 |
首次批准上 市 |
|
66 |
罗培干扰 素α-2b注射液 |
药华医药股份有限公 司 |
治疗用生物 制品 |
3.1 |
单药适用于既往接受羟基脲治疗效果不佳的真性红细胞增多症成人患者。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
PharmaEssentiaCorporation |
||||||
|
67 |
莫妥珠单 抗注射液 |
Roche Pharma (Schweiz) AG |
治疗用生物 制品 |
3.1 |
本品单药适用于既往接受过至少两线系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。 |
首次批准上 市 |
|
68 |
人促卵泡 激素δ注 射液 |
Ferring Pharmaceuticals A/Sv |
治疗用生物 制品 |
3.1 |
在接受辅助生殖技术(ART)周期治疗(如体外受精[IVF]或卵胞浆内单精子注射[ICSI])的女性中进行控制性卵巢刺激,以获得多个卵泡发育。 |
首次批准上 市 |
|
69 |
司美格鲁 肽片 |
Novo Nordisk A/S |
治疗用生物 制品 |
3.1 |
本品适用于成人2型糖尿病患者的血糖控制: • 可作为单药治疗,在饮食和运动基础上改善血糖控制。 • 在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病患者。 |
首次批准上 市 |
|
70 |
索米妥昔 单抗注射 液 |
ImmunoGen, Inc. |
治疗用生物 制品 |
3.1 |
本品适用于既往接受过1-3线系统性治疗的叶酸受体α(FRα) 阳性的铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。 |
首次批准上 市 |
|
71 |
特立妥单 抗注射液 |
Janssen-CilagInternational NV |
治疗用生物 制品 |
3.1 |
单药适用于既往至少接受过三线治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤成人患者。 |
首次批准上 市 |
|
72 |
注射用A 型肉毒毒 素 |
Merz Pharmaceuticals GmbH |
治疗用生物 制品 |
3.1 |
暂时改善65岁及65岁以下成人因皱眉肌和/或降眉间肌活动引起的中度及重度眉间纹。 |
首次批准上 市 |
|
73 |
注射用A 型肉毒毒 素 |
Revance Therapeutics,Inc. |
治疗用生物 制品 |
3.1 |
暂时性改善成人因皱眉肌和/或降眉间肌活动引起的中度至重度皱眉纹。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
74 |
注射用伏 尼凝血素 α |
Takeda PharmaceuticalsU.S.A., Inc. |
治疗用生物 制品 |
3.1 |
本品适用于诊断为血管性血友病(VWD)的成人患者(年龄为18岁及以上):按需治疗和出血事件的控制;围手术期出血管理。 |
首次批准上 市 |
|
75 |
注射用培 妥罗凝血 素α |
Novo Nordisk A/S |
治疗用生物 制品 |
3.1 |
本品适用于12岁及以上的血友病A(先天性凝血因子Ⅷ缺乏) 患者:按需治疗及控制出血事件;围手术期管理;常规预防治疗以防止或减少出血事件的发生。本品不适用于治疗血管性血友病(von Willebrand disease,vWD)。 |
首次批准上 市 |
|
76 |
注射用舒 索凝血素 α |
Takeda Pharmaceuticals U.S.A., Inc |
治疗用生物 制品 |
3.1 |
本品适用于获得性血友病A成人患者按需治疗和出血事件的控制。尚未确定本品在基线抗猪凝血因子Ⅷ抑制物滴度大于20 Bethesda单位(BU)的患者中的安全性和疗效。 |
首次批准上 市 |
|
77 |
注射用替 度格鲁肽 |
Takeda PharmaceuticalsInternational AG Ireland Branch |
治疗用生物 制品 |
3.1 |
本品适用于治疗短肠综合征成人和1岁及以上儿童患者。仅在患者经过一段时间肠道适应后,病情稳定且依赖肠外营养支持的情况下进行本品治疗。 |
首次批准上 市 |
|
78 |
注射用替 朗妥昔单 抗 |
ADC TherapeuticsSA |
治疗用生物 制品 |
3.1 |
本品单药适用于既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤(DLBCL)成人患者。 |
首次批准上 市 |
|
79 |
注射用维 恩妥尤单 抗 |
Astellas PharmaEurope B.V. |
治疗用生物 制品 |
3.1 |
本品用于既往接受过含铂化疗和程序性死亡受体-1(PD-1)或程序性死亡配体-1(PD-L1)抑制剂治疗的局部晚期或转移性尿路上皮癌成人患者。 |
首次批准上 市 |
|
80 |
注射用重 组人凝血因子Ⅷ |
Octapharma AB |
治疗用生物 制品 |
3.1 |
本品适用于治疗和预防血友病A(先天性凝血因子Ⅷ缺乏)患者的出血。 |
首次批准上 市 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
本品不适用于治疗血管性血友病(vonWillebrand disease,vWD)。 |
||||||
|
81 |
注射用利纳西普 |
Kiniksa Pharmaceuticals(UK),Ltd. |
治疗用生物 制品 |
3.1 |
冷吡啉相关周期性综合征(CAPS) 成人和12岁及以上青少年冷吡啉相关周期性综合征(CAPS),包括家族性寒冷性自身炎症综合征(FCAS)、Muckle-Wells综合征(MWS)。 复发性心包炎(RP) 成人和12岁及以上青少年复发性心包炎(RP)并降低复发风险。 |
首次批准上 市、增加适 应症 |
|
82 |
阿那白滞 素注射液 |
SwedishOrphanBiovitr umAB(publ) |
治疗用生物 制品 |
3.1 |
本品适用于中度至重度活动性斯蒂尔病患者,包括成人斯蒂尔病(AOSD)和8个月及以上的婴幼儿(体重≥10kg)、儿童、青少年全身型幼年特发性关节炎(sJIA),或用于接受非甾体抗炎药(NSAIDs)或糖皮质激素治疗后疾病仍处于活动状态的患 者。本品可单独给药,或与其他抗炎药和改善病情的抗风湿药物(DMARDs)联合使用。 |
增加适应症 |
|
83 |
比奇珠单 抗注射液 |
UCB PharmaS.A. |
治疗用生物 制品 |
3.1 |
用于非甾体类抗炎药(NSAID)给药后疗效不佳或不耐受的活动性放射学阴性中轴型脊柱关节炎伴客观炎症体征(根据C反应蛋白(CRP)升高和/或磁共振成像(MRI)检查提示)的成人患者 |
增加适应症 |
|
84 |
地舒单抗注射液 |
Amgen Europe B.V.,The Netherlands |
治疗用生物 制品 |
3.1 |
用于骨折高风险的糖皮质激素诱导的骨质疏松症。 |
增加适应症 |
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
注册 分类 |
适应症 |
首次批准上市/增加适应 症 |
|
85 |
美泊利珠 单抗注射 液 |
GlaxoSmithKline Trading Services Limited |
治疗用生物 制品 |
3.1 |
作为鼻内皮质类固醇的附加维持治疗药物,用于治疗全身性皮质类固醇和/或手术治疗无法充分控制疾病的慢性鼻窦炎伴鼻息肉(CRSwNP)成人患者。 |
增加适应症 |
|
86 |
帕博利珠 单抗注射 液 |
Merck Sharp& Dohme LLC |
治疗用生物 制品 |
3.1 |
适用于不可切除或转移性黑色素瘤的治疗。 本品联合曲妥珠单抗、含氟尿嘧啶类和铂类药物化疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥ 1)的局部晚期不可切除或转移性HER2阳性胃或胃食管结合部腺癌患者的一线治疗。 |
增加适应症 |
|
87 |
司库奇尤 单抗注射 液 |
NovartisPharmaSchwe izAG |
治疗用生物 制品 |
3.1 |
用于对于既往传统的改善病情抗风湿药(cDMARDs)疗效不佳或不耐受的活动性银屑病关节炎成人患者。 |
增加适应症 |
|
88 |
司美格鲁 肽注射液 |
Novo Nordisk A/S |
治疗用生物 制品 |
3.1 |
本品适用于在控制饮食和增加体力活动的基础上对成人患者的长期体重管理,初始体重指数(BMI)符合以下条件: • ≥30kg/m2(肥胖),或≥27kg/m2至<30kg/m2(超重)且存在至少一种体重相关合并症,例如高血糖、高血压、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病等。 |
增加适应症 |
|
89 |
注射用德 曲妥珠单 抗 |
DaiichiSankyo Europe GmbH |
治疗用生物 制品 |
3.1 |
附条件批准增加适应症,具体为:本品单药适用于治疗存在 HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患 者。 |
增加适应症 |
附件5 2024年国家药监局批准的药品纳入加快上市程序情况
2024年国家药监局批准的药品纳入加快上市程序情况
|
序号 |
药品名称 |
上市许可持有人 |
首次批准上市/增加适 应症 |
突破性治疗药 物程序 |
附条件批准程序 |
优先审评审 批程序 |
|
1 |
艾帕洛利托沃瑞利单抗注 射液 |
齐鲁制药有限公司 |
首次批准上市 |
√ |
||
|
2 |
艾曲泊帕乙醇胺干混悬剂 |
山东则正医药技术有限公司 |
首次批准上市 |
√ |
||
|
3 |
奥德昔巴特胶囊 |
Ipsen Pharma |
首次批准上市 |
√ |
||
|
4 |
贝组替凡片 |
MERCKSHARP & DOHME (UK) LIMITED |
首次批准上市 |
√ |
||
|
5 |
本维莫德乳膏 |
上海泽德曼医药科技有限公司 |
首次批准上市 |
√ |
||
|
6 |
苯乙酸钠苯甲酸钠注射用 浓溶液 |
安徽沃泰生物医药有限公司 |
首次批准上市 |
√ |
||
|
7 |
泊那替尼片 |
Otsuka PharmaceuticalCo., Ltd. |
首次批准上市 |
√ |
||
|
8 |
醋酸氟氢可的松片 |
ASPEN PHARMATRADING LIMITED |
首次批准上市 |
√ |
||
|
9 |
醋酸锌片 |
NobelpharmaCo.,Ltd. |
首次批准上市 |
√ |
||
|
10 |
对乙酰氨基酚栓 |
浙江尔婴药品有限公司 |
首次批准上市 |
√ |
||
|
11 |
多奈单抗注射液 |
Eli Lilly andCompany |
首次批准上市 |
√ |
√ |
|
序号 |
药品名称 |
上市许可持有人 |
首次批准上市/增加适 应症 |
突破性治疗药 物程序 |
附条件批准程序 |
优先审评审 批程序 |
|
12 |
恩朗苏拜单抗注射液 |
石药集团巨石生物制药有限公司 |
首次批准上市 |
√ |
||
|
13 |
二氮嗪口服混悬液 |
宿州亿帆药业有限公司 |
首次批准上市 |
√ |
||
|
14 |
伐莫洛龙口服混悬液 |
Santhera Pharmaceuticals(Deutschland)GmbH |
首次批准上市 |
√ |
√ |
|
|
15 |
氟泽雷塞片 |
信达生物科技有限公司 |
首次批准上市 |
√ |
√ |
√ |
|
16 |
戈利昔替尼胶囊 |
迪哲(江苏)医药股份有限公司 |
首次批准上市 |
√ |
√ |
|
|
17 |
格索雷塞片 |
上海正大天晴医药科技开发有限公 司 |
首次批准上市 |
√ |
√ |
√ |
|
18 |
己二酸他雷替尼胶囊 |
葆元生物医药科技(杭州)有限公 司 |
首次批准上市 |
√ |
√ |
√ |
|
19 |
加那索龙口服混悬剂 |
Marinus Pharmaceuticals,Inc. |
首次批准上市 |
√ |
||
|
20 |
甲氨蝶呤注射液 |
四川汇宇制药股份有限公司 |
首次批准上市 |
√ |
||
|
21 |
可伐利单抗注射液 |
Roche Pharma (Schweiz) AG |
首次批准上市 |
√ |
√ |
|
|
22 |
磷酸奥唑司他片 |
Recordati Rare Diseases |
首次批准上市 |
√ |
||
|
23 |
磷酸二氢钠磷酸氢二钠颗 粒 |
嘉实(湖南)医药科技有限公司 |
首次批准上市 |
√ |
||
|
24 |
硫酸阿托品滴眼液 |
沈阳兴齐眼药股份有限公司 |
首次批准上市 |
√ |
|
序号 |
药品名称 |
上市许可持有人 |
首次批准上市/增加适 应症 |
突破性治疗药 物程序 |
附条件批准程序 |
优先审评审 批程序 |
|
25 |
仑卡奈单抗注射液 |
Eisai Inc. |
首次批准上市 |
√ |
||
|
26 |
马来酸阿可替尼片 |
AstraZeneca Pty Ltd |
首次批准上市 |
√ |
||
|
27 |
玛伐凯泰胶囊 |
Bristol-MyersSquibbAustralia Pty Ltd |
首次批准上市 |
√ |
√ |
|
|
28 |
莫妥珠单抗注射液 |
Roche Pharma (Schweiz) AG |
首次批准上市 |
√ |
√ |
|
|
29 |
佩索利单抗注射液(皮下 注射) |
Boehringer Ingelheim International GmbH |
首次批准上市 |
√ |
√ |
|
|
30 |
匹妥布替尼片 |
Eli Lilly Nederland B.V. |
首次批准上市 |
√ |
√ |
|
|
31 |
瑞普替尼胶囊 |
Bristol-MyersSquibb Company |
首次批准上市 |
√ |
√ |
√ |
|
32 |
司普奇拜单抗注射液 |
成都康诺行生物医药科技有限公司 |
首次批准上市 |
√ |
√ |
|
|
33 |
索米妥昔单抗注射液 |
ImmunoGen, Inc. |
首次批准上市 |
√ |
√ |
|
|
34 |
特立妥单抗注射液 |
Janssen-Cilag International NV |
首次批准上市 |
√ |
√ |
√ |
|
35 |
托夫生注射液 |
Biogen MA Inc. |
首次批准上市 |
√ |
||
|
36 |
妥拉美替尼胶囊 |
上海科州药物研发有限公司 |
首次批准上市 |
√ |
√ |
|
|
37 |
西达基奥仑赛注射液 |
南京传奇生物科技有限公司 |
首次批准上市 |
√ |
√ |
√ |
|
序号 |
药品名称 |
上市许可持有人 |
首次批准上市/增加适 应症 |
突破性治疗药 物程序 |
附条件批准程序 |
优先审评审 批程序 |
|
38 |
熊去氧胆酸口服混悬液 |
Dr. Falk Pharma GmbH |
首次批准上市 |
√ |
||
|
39 |
盐酸米诺环素泡沫剂 |
Journey Medical Corporation |
首次批准上市 |
√ |
||
|
40 |
盐酸纳曲酮植入剂 |
深圳善康医药科技股份有限公司 |
首次批准上市 |
√ |
√ |
|
|
41 |
盐酸曲恩汀胶囊 |
NavintaLLC |
首次批准上市 |
√ |
||
|
42 |
盐酸万古霉素胶囊 |
时森海(杭州)医药科技有限公司 |
首次批准上市 |
√ |
||
|
43 |
盐酸西替利嗪滴眼液 |
苏州欧康维视生物科技有限公司 |
首次批准上市 |
√ |
||
|
44 |
盐酸伊普可泮胶囊 |
Novartis PharmaSchweizAG |
首次批准上市 |
√ |
√ |
|
|
45 |
盐酸异丙肾上腺素注射液 |
成都欣捷高新技术开发股份有限公 司 |
首次批准上市 |
√ |
||
|
46 |
依沃西单抗注射液 |
康方赛诺医药有限公司 |
首次批准上市 |
√ |
√ |
|
|
47 |
泽沃基奥仑赛注射液 |
恺兴生命科技(上海)有限公司 |
首次批准上市 |
√ |
√ |
√ |
|
48 |
注射用伏尼凝血素α |
Takeda Pharmaceuticals U.S.A., Inc. |
首次批准上市 |
√ |
||
|
49 |
注射用环磷酰胺 |
四川汇宇制药股份有限公司 |
首次批准上市 |
√ |
||
|
50 |
注射用利纳西普 |
Kiniksa Pharmaceuticals (UK),Ltd. |
首次批准上市 |
√ |
|
序号 |
药品名称 |
上市许可持有人 |
首次批准上市/增加适 应症 |
突破性治疗药 物程序 |
附条件批准程序 |
优先审评审 批程序 |
|
51 |
注射用芦比替定 |
PharmaMarAG |
首次批准上市 |
√ |
√ |
|
|
52 |
注射用芦康沙妥珠单抗 |
四川科伦博泰生物医药股份有限公 司 |
首次批准上市 |
√ |
√ |
|
|
53 |
注射用罗替高汀微球 |
绿叶嘉奥制药石家庄有限公司 |
首次批准上市 |
√ |
||
|
54 |
注射用培妥罗凝血素α |
NovoNordiskA/S |
首次批准上市 |
√ |
||
|
55 |
注射用舒巴坦钠/注射用度洛巴坦钠组合包装 |
Entasis Therapeutics, Inc. |
首次批准上市 |
√ |
||
|
56 |
注射用舒索凝血素α |
Takeda Pharmaceuticals U.S.A., Inc |
首次批准上市 |
√ |
||
|
57 |
注射用替朗妥昔单抗 |
ADC TherapeuticsSA |
首次批准上市 |
√ |
√ |
|
|
58 |
阿布昔替尼片 |
Pfizer Inc. |
增加适应症 |
√ |
||
|
59 |
艾加莫德α注射液(皮下 注射) |
argenx BV |
增加适应症 |
√ |
√ |
|
|
60 |
贝莫苏拜单抗注射液 |
正大天晴药业集团南京顺欣制药有 限公司 |
增加适应症 |
√ |
√ |
√ |
|
61 |
伯瑞替尼肠溶胶囊 |
北京浦润奥生物科技有限责任公司 |
增加适应症 |
√ |
||
|
62 |
恩曲替尼胶囊 |
Roche Pharma (Schweiz) AG |
增加适应症 |
√ |
√ |
|
|
63 |
呋喹替尼胶囊 |
和记黄埔医药(上海)有限公司 |
增加适应症 |
√ |
√ |
√ |
|
序号 |
药品名称 |
上市许可持有人 |
首次批准上市/增加适 应症 |
突破性治疗药 物程序 |
附条件批准程序 |
优先审评审 批程序 |
|
64 |
氟唑帕利胶囊 |
江苏恒瑞医药股份有限公司 |
增加适应症 |
√ |
√ |
|
|
65 |
甲磺酸阿帕替尼片 |
江苏恒瑞医药股份有限公司 |
增加适应症 |
√ |
√ |
|
|
66 |
甲磺酸奥希替尼片 |
AstraZeneca AB |
增加适应症 |
√ |
√ |
|
|
67 |
聚乙二醇重组人生长激素 注射液 |
长春金赛药业有限责任公司 |
增加适应症 |
√ |
||
|
68 |
纳武利尤单抗注射液 |
Bristol-MyersSquibb Pharma EEIG |
增加适应症 |
√ |
√ |
|
|
69 |
瑞基奥仑赛注射液 |
上海药明巨诺生物科技有限公司 |
增加适应症 |
√ |
√ |
|
|
70 |
塞利尼索片 |
Karyopharm Therapeutics Inc. |
增加适应症 |
√ |
√ |
|
|
71 |
西达本胺片 |
深圳微芯生物科技股份有限公司 |
增加适应症 |
√ |
√ |
|
|
72 |
信迪利单抗注射液 |
信达生物制药(苏州)有限公司 |
增加适应症 |
√ |
√ |
√ |
|
73 |
盐酸阿来替尼胶囊 |
Roche Registration GmbH |
增加适应症 |
√ |
√ |
|
|
74 |
盐酸安罗替尼胶囊 |
正大天晴药业集团股份有限公司 |
增加适应症 |
√ |
√ |
√ |
|
75 |
盐酸替洛利生片 |
Bioprojet Pharma |
增加适应症 |
√ |
||
|
76 |
伊匹木单抗注射液 |
Bristol-MyersSquibb Pharma EEIG |
增加适应症 |
√ |
√ |
|
序号 |
药品名称 |
上市许可持有人 |
首次批准上市/增加适 应症 |
突破性治疗药 物程序 |
附条件批准程序 |
优先审评审 批程序 |
|
77 |
泽布替尼胶囊 |
百济神州(苏州)生物科技有限公 司 |
增加适应症 |
√ |
√ |
|
|
78 |
注射用德曲妥珠单抗 |
DaiichiSankyo Europe GmbH |
增加适应症 |
√ |
√ |
√ |
附件6 2024年纳入突破性治疗药物程序的药物
2024年纳入突破性治疗药物程序的药物
|
序号 |
药品名称 |
适应症 |
|
1 |
9MW2821 |
既往铂类化疗和PD-(L)1抑制剂治疗失败的局部晚期或转移性尿路上皮癌 |
|
2 |
AAV5-hRKp.RPGR眼内注射溶液 |
AAV5-hRKp.RPGR是一种基于腺相关病毒载体的基因治疗药物,适用于治疗确诊为RPGR 致病性变异相关X连锁型视网膜色素变性(RPGR-XLRP)的患者。患者必须经治疗医师确定有足量存活视网膜细胞。 |
|
3 |
AHB-137注射液 |
慢性乙型肝炎 |
|
4 |
AL01211胶囊 |
法布雷病 |
|
5 |
AP-306胶囊 |
慢性肾脏病高磷血症 |
|
6 |
BAY 2927088片 |
BAY2927088适用于治疗携带HER2(ERBB2)激活突变且既往接受过一种全身性治疗的不可切除或转移性非小细胞肺癌(NSCLC)成人患者。 |
|
7 |
BAY 2927088溶液 |
BAY2927088适用于治疗携带HER2(ERBB2)激活突变且既往接受过一种全身性治疗的不可切除或转移性非小细胞肺癌(NSCLC)成人患者。 |
|
8 |
BI1810631片 |
用于治疗携带人表皮生长因子受体-2(HER2)既往接受过全身治疗的晚期、不可切除或转移性非小细胞肺癌(NSCLC)成人患者。 |
|
9 |
BI 456906注射液 |
拟用于代谢功能障碍相关脂肪性肝炎(MASH)的治疗 |
|
10 |
BN104片 |
本品拟用于治疗携带KMT2A重排和/或NPM1突变的复发/难治性急性白血病。 |
|
11 |
BRII-835(VIR-2218) 注射液 |
BRII-835(VIR-2218)适用于治疗慢性乙型肝炎病毒(HBV)感染和慢性乙型肝炎病毒(HBV)/丁型肝炎病毒(HDV)感染。 |
|
序号 |
药品名称 |
适应症 |
|
12 |
D-1553片 |
联合西妥昔单抗注射液拟用于经2线标准治疗(包括奥沙利铂、伊立替康、5-氟尿嘧啶和抗VEGF单抗)失败、KRAS G12C突变阳性的手术无法切除的局部晚期或转移性结直肠癌患者。 |
|
13 |
D-1553片 |
用于治疗经一线治疗失败的伴KRAS G12C突变局部晚期或转移性胰腺导管腺癌 |
|
14 |
DZD9008片 |
未接受过系统性治疗、携带EGFR 20号外显子插入突变的局部进展或转移性非小细胞肺癌 |
|
15 |
GC101腺相关病毒注射液 |
2型脊髓性肌萎缩症(5qSMA) |
|
16 |
GDC-0077 |
Inavolisib与哌柏西利和内分泌疗法联合用药适用于治疗PIK3CA突变、激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性、局部晚期或转移性乳腺癌成人患者。 |
|
17 |
GR1803注射液 |
复发难治性多发性骨髓瘤 |
|
18 |
GR2001注射液 |
预防破伤风 |
|
19 |
GST-HG141片 |
本品拟用于慢性乙型肝炎(CHB)的治疗。 |
|
20 |
HL-085胶囊 |
联合维莫非尼用于治疗既往接受过系统性治疗的BRAFV600E突变的转移性结直肠癌(mCRC)成人患者 |
|
21 |
HMI-115 |
用于治疗子宫内膜异位症相关的中重度疼痛 |
|
22 |
HR19042胶囊 |
活动性自身免疫性肝炎 |
|
23 |
HSK31858片 |
非囊性纤维化支气管扩张 |
|
24 |
IBI308 |
本品联合IBI310用于可切除的高微卫星不稳定性(MSI-H)或错配修复基因缺陷型(dMMR)结肠癌的新辅助治疗。 |
|
序号 |
药品名称 |
适应症 |
|
25 |
IBI310 |
本品联合信迪利单抗用于可切除的高微卫星不稳定性(MSI-H)或错配修复基因缺陷型(dMMR)结肠癌的新辅助治疗。 |
|
26 |
IBI343 |
至少接受过二种系统性治疗的Claudin(CLDN)18.2表达阳性的晚期胃/胃食管交界处腺癌 |
|
27 |
IBI354 |
HER2表达(IHC1+、2+或3+)的铂耐药卵巢癌 |
|
28 |
IN10018片 |
IN10018联合D-1553治疗一线KRASG12C突变阳性的局晚期或转移性非小细胞肺癌(NSCLC) |
|
29 |
JAB-21822片 |
联合西妥昔单抗注射液拟用于经2线标准治疗(包括奥沙利铂、伊立替康、5-氟尿嘧啶,联合或不联合抗VEGF单抗)失败、KRASG12C突变阳性的手术无法切除的局部晚期或转移性结直肠癌患者。 |
|
30 |
JL15003注射液 |
复发胶质母细胞瘤 |
|
31 |
Lorlatinib片 |
用于克唑替尼和含铂化疗治疗后的局部晚期或转移性ROS1阳性非小细胞肺癌患者 |
|
32 |
LP-168片 |
单药治疗既往接受过至少两线治疗的成人复发或难治性非生发中心B细胞型(non-GCB)弥漫性大B细胞淋巴瘤(DLBCL) |
|
33 |
LX101注射液 |
适用于治疗RPE65双等位基因突变相关的遗传性视网膜营养不良(IRD)患者。 |
|
34 |
MEDI3506注射液 |
Tozorakimab(MEDI3506)旨在为需要氧疗的病毒性肺部感染住院患者降低进展为创伤性机械通气(IMV)/体外膜肺氧合(ECMO)和死亡的风险。 |
|
35 |
PM8002注射液 |
PM8002 注射液联合注射用白蛋白结合型紫杉醇一线治疗不可手术的局部晚期/复发转移性三阴性乳腺癌 |
|
36 |
QX005N注射液 |
成人中重度结节性痒疹 |
|
37 |
SC0062胶囊 |
SC0062胶囊拟用于治疗伴有蛋白尿的IgA肾病。 |
|
序号 |
药品名称 |
适应症 |
|
38 |
SHR-1918注射液 |
纯合子家族性高胆固醇血症 |
|
39 |
TAEST16001注射液 |
拟用于治疗组织基因型为HLA-A*02:01,肿瘤抗原NY-ESO-1表达为阳性的软组织肉瘤 |
|
40 |
TAK-861片 |
发作性睡病1型 |
|
41 |
TQB2450注射液 |
贝莫苏拜单抗与盐酸安罗替尼胶囊联合用于腺泡状软组织肉瘤患者的治疗 |
|
42 |
TVAX-008 |
TVAX-008注射液适用于治疗慢性乙型肝炎病毒(HBV)感染 |
|
43 |
Upadacitinib片 |
用于12岁及以上的青少年和成人非节段型白癜风患者 |
|
44 |
VGR-R01 |
结晶样视网膜变性(BCD) |
|
45 |
VSA003注射液 |
纯合子型家族性高胆固醇血症:成人纯合子型家族性高胆固醇血症(HoFH)可用于在饮食疗法和其他降脂治疗(例如他汀类药物、PCSK9抑制剂、依折麦布、低密度脂蛋白胆固醇LDL-C血浆分离置换术)基础上且需要进一步降低LDL-C的HoFH患者,或其他降脂治疗无效、或不耐受其他降脂治疗的HoFH患者。 |
|
46 |
XNW5004片 |
XNW5004拟用于治疗复发或难治性外周T细胞淋巴瘤 |
|
47 |
ZN-A-1041肠溶胶囊 |
ZN-A-1041联合卡培他滨和曲妥珠单抗用于既往接受过含曲妥珠单抗治疗进展的人表皮生长因子受体2阳性(HER2阳性)晚期脑转移乳腺癌患者 |
|
48 |
ZVS101e 注射液 |
结晶样视网膜变性(Bietti’s crystalline dystrophy, BCD) |
|
49 |
氟唑帕利胶囊 |
氟唑帕利单药或联合阿帕替尼治疗gBRCA突变的HER2阴性乳腺癌。 |
|
50 |
甲磺酸阿美替尼片 |
用于含铂根治性放化疗后未出现疾病进展的不可切除的局部晚期表皮生长因子受体(EGFR)外显子19 缺失或外显子21(L858R)置换突变的非小细胞肺癌患者的治疗 |
|
序号 |
药品名称 |
适应症 |
|
51 |
甲磺酸阿帕替尼片 |
阿帕替尼联合氟唑帕利治疗gBRCA突变的HER2阴性乳腺癌。 |
|
52 |
甲磺酸奥希替尼片 |
奥希替尼用于在接受含铂根治性放化疗后未出现疾病进展、具有表皮生长因子受体(EGFR)外显子19缺失(Ex19del)或外显子21(L858R)置换突变的局部晚期,不可切除(III 期)非小细胞肺癌(NSCLC)成人患者的治疗。 |
|
53 |
甲磺酸伏美替尼片 |
本品适用于具有表皮生长因子受体(EGFR)20 外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。 |
|
54 |
具有沉默白介素6表达功能的靶向CD19 基因工程化自体T细胞注射液 |
难治复发急性淋巴细胞白血病 |
|
55 |
抗CD19 单链抗体嵌合抗原受体T细胞注射液 |
25岁(含)以下CD19阳性复发/难治B细胞急性淋巴细胞白血病 |
|
56 |
马来酸苏特替尼胶囊 |
局部晚期或转移性非小细胞肺癌(仅限非耐药性罕见EGFR突变,包括L861Q、G719X和/或S768I) |
|
57 |
纳武利尤单抗注射液 |
纳武利尤单抗联合伊匹木单抗用于一线治疗不可切除或转移性微卫星高度不稳定性(MSI-H)或错配修复缺陷型(dMMR)结直肠癌(CRC)患者。 |
|
58 |
普那利单抗注射液 |
复发难治性风湿性疾病相关噬血细胞性淋巴组织细胞增多症(R/R MAS) |
|
59 |
赛沃替尼片 |
赛沃替尼联合奥希替尼治疗经EGFR-TKI治疗失败伴MET扩增的局部晚期或转移性非小细胞肺癌 |
|
60 |
输注用无菌冻干粉Telisotuzumab Vedotin |
用于治疗在铂类药物治疗期间或治疗后发生疾病进展的c-Met 蛋白高表达(OE)晚期/转移性表皮生长因子受体(EGFR)野生型(WT)非鳞状(NSq)非小细胞肺癌(NSCLC)患者. |
|
61 |
西达本胺片 |
西达本胺联合信迪利单抗和贝伐珠单抗用于既往≥2 线标准治疗失败的晚期微卫星稳定或错配修复完整(MSS/ pMMR)型的结直肠癌(colorectalcancer,CRC) |
|
序号 |
药品名称 |
适应症 |
|
62 |
伊匹木单抗注射液 |
伊匹木单抗联合纳武利尤单抗用于一线治疗不可切除或转移性微卫星高度不稳定性(MSI-H)或错配修复缺陷型(dMMR)结直肠癌(CRC)患者。 |
|
63 |
重组人IL12/15-PDL1B单纯疱疹I型溶瘤病毒注射液(Vero细胞) |
经标准治疗失败的晚期肝细胞癌 |
|
64 |
重组人源化PDL1 单域抗体Fc融合蛋白注射液 |
恩沃利单抗用于既往标准治疗失败且无满意替代治疗的高肿瘤突变负荷(TMB-H)不可切除或转移性实体瘤 |
|
65 |
重组人源化抗Trop2 单抗-SN38偶联物 |
既往未经系统治疗的不可手术的局部晚期、复发或转移性PD-L1阴性三阴性乳腺癌 |
|
66 |
注射用Belantamabmafodotin |
Belantamabmafodotin与硼替佐米和地塞米松联合,用于治疗既往接受过至少一种治疗的多发性骨髓瘤成年患者。 |
|
67 |
注射用BL-B01D1 |
既往经PD-1/PD-L1 单抗治疗且经至少两线化疗(至少一线含铂)治疗失败的复发性或转移性鼻咽癌患者 |
|
68 |
注射用BL-B01D1 |
既往经PD-1/PD-L1单抗联合含铂化疗治疗失败的复发性或转移性食管鳞癌患者 |
|
69 |
注射用BL-B01D1 |
既往经抗PD-1/PD-L1单抗治疗且经含铂化疗治疗失败的局部晚期或转移性EGFR野生型非小细胞肺癌患者 |
|
70 |
注射用BL-B01D1 |
经EGFR-TKI治疗失败的EGFR敏感突变的局部晚期或转移性非鳞状非小细胞肺癌患者 |
|
71 |
注射用BRII-877(VIR-3434) |
BRII-877(VIR-3434)适用于治疗慢性乙型肝炎病毒(HBV)感染和慢性乙型肝炎病毒(HBV)/丁型肝炎病毒(HDV)感染。 |
|
72 |
注射用DB-1303 |
用于治疗既往免疫检查点抑制剂(ICI)治疗期间或治疗后进展的晚期、复发性或转移性HER2表达(免疫组化[IHC] 3+、IHC 2+、IHC1+)子宫内膜癌。 |
|
73 |
注射用HS-20093 |
经标准一线治疗(含铂双药化疗联合免疫)后进展的广泛期小细胞肺癌 |
|
序号 |
药品名称 |
适应症 |
|
74 |
注射用KJ103 |
适用于高度致敏的肾移植患者进行脱敏治疗,有效清除预存HLA抗体预防超急性排斥反应 |
|
75 |
注射用LBL-024 |
LBL-024单药治疗既往接受过二线及以上化疗后进展的晚期肺外神经内分泌癌患者 |
|
76 |
注射用SHR-A1811 |
既往至少一线抗HER2治疗失败的HER2阳性晚期胃癌或胃食管结合部腺癌患者 |
|
77 |
注射用SHR-A1811 |
注射用SHR-A1811用于既往接受过一种或一种以上治疗方案的HER2 阳性不可切除或转移性胆道癌患者。 |
|
78 |
注射用SHR-A1811 |
注射用SHR-A1811治疗HER2表达的铂耐药复发上皮性卵巢癌、输卵管癌或原发性腹膜癌。 |
|
79 |
注射用SHR-A1921 |
注射用SHR-A1921治疗铂耐药复发上皮性卵巢癌、输卵管癌或原发性腹膜癌 |
|
80 |
注射用SHR-A2102 |
注射用SHR-A2102单药治疗既往含铂化疗和PD-(L)1抑制剂治疗失败的局部晚期或转移性尿路上皮癌。 |
|
81 |
注射用SKB264 |
既往未接受过系统治疗的不可手术切除的局部晚期、复发或转移性PD-L1阴性三阴性乳腺癌患者 |
|
82 |
注射用TRS005 |
至少经过2次标准治疗的复发或难治性CD20阳性弥漫大B细胞淋巴瘤 |
|
83 |
注射用YL201 |
经初始含铂治疗失败的复发性小细胞肺癌 |
|
84 |
注射用维迪西妥单抗 |
注射用维迪西妥单抗联合特瑞普利单抗注射液围手术期治疗存在HER2表达且计划进行根治性膀胱切除术的肌层浸润性膀胱癌 |
附件7 2024年国家药监局附条件批准的药品
2024年国家药监局附条件批准的药品
|
序号 |
药品通用名称 |
药品上市许可持有人 |
附条件批准适应症 |
首次批准上市/增加适应症 |
|
1 |
艾帕洛利托沃瑞利单抗注射液 |
齐鲁制药有限公司 |
本品适用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。 |
首次批准上市 |
|
2 |
恩朗苏拜单抗注射液 |
石药集团巨石生物制药有限公司 |
适用于既往接受含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)的复发或转移性宫颈癌患者。 |
首次批准上市 |
|
3 |
氟泽雷塞片 |
信达生物科技有限公 司 |
本品适用于至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。 |
首次批准上市 |
|
4 |
戈利昔替尼胶囊 |
迪哲(江苏)医药股份有限公司 |
本品单药适用于既往至少接受过一线系统性治疗的复发或难外周T细胞淋巴瘤(r/r PTCL) |
首次批准上市 |
|
5 |
格索雷塞片 |
上海正大天晴医药科技开发有限公司 |
本品适用于至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。 |
首次批准上市 |
|
6 |
己二酸他雷替尼胶囊 |
葆元生物医药科技(杭州)有限公司 |
用于经ROS1-TKI治疗后进展的ROS1 阳性局部晚期或转移性非小细胞肺癌(NSCLC)成人患者 |
首次批准上市 |
|
7 |
马来酸阿可替尼片 |
AstraZeneca Pty Ltd |
既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者。 |
首次批准上市 |
|
8 |
莫妥珠单抗注射液 |
Roche Pharma(Schweiz)AG |
本品单药适用于既往接受过至少两线系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。 |
首次批准上市 |
|
9 |
匹妥布替尼片 |
Eli Lilly Nederland B.V. |
单药适用于既往接受过至少两种系统性治疗(含布鲁顿氏酪氨酸激酶[BTK]抑制剂)的复发或难治性套细胞淋巴瘤(MCL)成人患者 |
首次批准上市 |
|
序号 |
药品通用名称 |
药品上市许可持有人 |
附条件批准适应症 |
首次批准上市/增加适应症 |
|
10 |
瑞普替尼胶囊 |
Bristol-MyersSquibbCompany |
本品适用于ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。 |
首次批准上市 |
|
11 |
索米妥昔单抗注射液 |
ImmunoGen, Inc. |
本品适用于既往接受过1-3线系统性治疗的叶酸受体α(FRα)阳性的铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。 |
首次批准上市 |
|
12 |
特立妥单抗注射液 |
Janssen-CilagInternational NV |
单药适用于既往至少接受过三线治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38 单克隆抗体)的复发或难治性多发性骨髓瘤成人患者 |
首次批准上市 |
|
13 |
托夫生注射液 |
Biogen MA Inc. |
本品用于治疗携带超氧化物歧化酶1(SOD1)基因突变的肌萎缩侧索硬化(ALS)成人患者。 |
首次批准上市 |
|
14 |
妥拉美替尼胶囊 |
上海科州药物研发有限公司 |
本品适用于含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。 |
首次批准上市 |
|
15 |
西达基奥仑赛注射液 |
南京传奇生物科技有限公司 |
用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。 |
首次批准上市 |
|
16 |
泽沃基奥仑赛注射液 |
恺兴生命科技(上海)有限公司 |
用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。 |
首次批准上市 |
|
17 |
注射用芦比替定 |
PharmaMarAG |
本品适用于治疗含铂化疗中或化疗后疾病进展的转移性小细胞肺癌(SCLC)成人患者。 |
首次批准上市 |
|
18 |
注射用替朗妥昔单抗 |
ADC TherapeuticsSA |
单药适用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤(DLBCL)成人患者。 |
首次批准上市 |
|
序号 |
药品通用名称 |
药品上市许可持有人 |
附条件批准适应症 |
首次批准上市/增加适应症 |
|
19 |
贝莫苏拜单抗注射液 |
正大天晴药业集团南京顺欣制药有限公司 |
本品联合盐酸安罗替尼胶囊,用于既往系统性抗肿瘤治疗后失败且不适合进行根治性手术治疗或根治性放疗的非微卫星高度不稳定(非MSI-H)或非错配修复基因缺陷(非dMMR)的复发性或转移性子宫内膜癌的治疗。 |
增加适应症 |
|
20 |
恩曲替尼胶囊 |
Roche Pharma(Schweiz)AG |
扩展适应症人群,用于符合下列条件的成人和1月龄以上儿童实体瘤患者:经充分验证的检测方法诊断为携带神经营养酪氨酸受体激酶(NTRK)融合基因且不包括已知获得性耐药突变,患有局部晚期、转移性疾病或手术切除可能导致严重并发症的患者,以及无满意替代治疗或既往治疗失败的患者。 |
增加适应症 |
|
21 |
呋喹替尼胶囊 |
和记黄埔医药(上海)有限公司 |
本品联合信迪利单抗注射液用于既往系统性抗肿瘤治疗后失败且不适合进行根治性手术治疗或根治性放疗的晚期错配修复完整(pMMR)子宫内膜癌患者。 |
增加适应症 |
|
22 |
己二酸他雷替尼胶囊 |
葆元生物医药科技(杭州)有限公司 |
本品适用于ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。 |
增加适应症 |
|
23 |
塞利尼索片 |
Karyopharm Therapeutics Inc. |
本品单药适用于既往接受过至少两线系统性治疗的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者 |
增加适应症 |
|
24 |
西达本胺片 |
深圳微芯生物科技股份有限公司 |
联合R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和强的松)用于MYC和BCL2表达阳性的既往未经治疗的弥漫大B细胞淋巴瘤(DLBCL)患者。 |
增加适应症 |
|
25 |
信迪利单抗注射液 |
信达生物制药(苏州)有限公司 |
本品联合呋喹替尼胶囊用于既往系统性抗肿瘤治疗后失败且不适合进行根治性手术治疗或根治性放疗的晚期错配修复完整(pMMR)子宫内膜癌患者。 |
增加适应症 |
|
序号 |
药品通用名称 |
药品上市许可持有人 |
附条件批准适应症 |
首次批准上市/增加适应症 |
|
26 |
盐酸安罗替尼胶囊 |
正大天晴药业集团股份有限公司 |
本品联合贝莫苏拜单抗注射液,用于既往系统性抗肿瘤治疗后失败且不适合进行根治性手术治疗或根治性放疗的非微卫星高度不稳定(非MSI-H)或非错配修复基因缺陷(非dMMR)的复发性或转移性子宫内膜癌的治疗。 |
增加适应症 |
|
27 |
泽布替尼胶囊 |
百济神州(苏州)生物科技有限公司 |
本品联合奥妥珠单抗,适用于:既往接受过至少二线系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。 |
增加适应症 |
|
28 |
注射用德曲妥珠单抗 |
DaiichiSankyoEurope GmbH |
本品单药适用于治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者。 |
增加适应症 |
|
29 |
注射用德曲妥珠单抗 |
DaiichiSankyoEurope GmbH |
本品单药适用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。 |
增加适应症 |
附件8 2024年药审中心发布的指导原则
2024年药审中心发布的指导原则
|
序号 |
通告号 |
指导原则 |
发布时间 |
|
1 |
2024年第1号 |
基于药代动力学方法支持用于肿瘤治疗的抗PD-1/PD-L1抗体可选给药方案的技术指导原则 |
2024/1/10 |
|
2 |
2024年第2号 |
治疗用重组蛋白产品临床试验申请病毒清除工艺平台验证技术指导原则(试行) |
2024/1/16 |
|
3 |
2024年第3号 |
抗肿瘤药物说明书安全性信息撰写技术指导原则 |
2024/1/16 |
|
4 |
2024年第4号 |
放射性标记人体物质平衡研究技术指导原则 |
2024/1/16 |
|
5 |
2024年第5号 |
药物免疫毒性非临床研究技术指导原则 |
2024/1/18 |
|
6 |
2024年第6号 |
人源干细胞产品非临床研究技术指导原则 |
2024/1/18 |
|
7 |
2024年第7号 |
间充质干细胞防治移植物抗宿主病临床试验技术指导原则(试行) |
2024/1/18 |
|
8 |
2024年第7号 |
罕见病基因治疗产品临床试验技术指导原则(试行) |
2024/1/18 |
|
9 |
2024年第8号 |
重组腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则 |
2024/1/19 |
|
10 |
2024年第9号 |
放射性治疗药物非临床研究技术指导原则 |
2024/1/24 |
|
11 |
2024年第10号 |
化学药改良型新药临床药理学研究技术指导原则(试行) |
2024/2/4 |
|
12 |
2024年第11号 |
放射性化学仿制药药学研究技术指导原则 |
2024/2/5 |
|
13 |
2024年第12号 |
药品注册研发生产主体合规信息管理与审查指导原则(试行) |
2024/2/5 |
|
14 |
2024年第13号 |
微型片剂(化学药品)药学研究技术指导原则(试行) |
2024/2/8 |
|
15 |
2024年第14号 |
抗体偶联药物药学研究与评价技术指导原则 |
2024/2/8 |
|
16 |
2024年第15号 |
低分子量肝素类仿制药药学研究与评价技术指导原则(试行) |
2024/2/22 |
|
17 |
2024年第17号 |
罕见病酶替代疗法药物非临床研究指导原则(试行) |
2024/2/23 |
|
18 |
2024年第16号 |
中药制剂稳定性研究技术指导原则(试行) |
2024/2/27 |
|
19 |
2024年第16号 |
中药制剂特征图谱研究技术指导原则(试行) |
2024/2/27 |
|
20 |
2024年第18号 |
生长激素制剂用于生长激素缺乏症临床试验技术指导原则 |
2024/3/1 |
|
21 |
2024年第19号 |
小儿便秘中药新药临床研发技术指导原则(试行) |
2024/3/1 |
|
22 |
2024年第20号 |
按古代经典名方目录管理的中药复方制剂药学申报资料撰写指导原则(试行) |
2024/4/23 |
|
23 |
2024年第21号 |
中药新药用于紧张型头痛的临床疗效评价技术指导原则(试行) |
2024/5/6 |
|
24 |
2024年第23号 |
恩扎卢胺软胶囊生物等效性研究技术指导原则 |
2024/5/14 |
|
25 |
2024年第23号 |
艾曲泊帕乙醇胺片生物等效性研究技术指导原则 |
2024/5/14 |
|
26 |
2024年第23号 |
注射用醋酸亮丙瑞林微球生物等效性研究技术指导原则 |
2024/5/14 |
|
27 |
2024年第23号 |
奥美拉唑碳酸氢钠胶囊生物等效性研究技术指导原则 |
2024/5/14 |
|
28 |
2024年第23号 |
奥美拉唑碳酸氢钠干混悬剂生物等效性研究技术指导原则 |
2024/5/14 |
|
29 |
2024年第23号 |
注射用醋酸奥曲肽微球生物等效性研究技术指导原则 |
2024/5/14 |
|
30 |
2024年第23号 |
瑞戈非尼片生物等效性研究技术指导原则 |
2024/5/14 |
|
31 |
2024年第23号 |
巯嘌呤片生物等效性研究技术指导原则 |
2024/5/14 |
|
32 |
2024年第23号 |
硫唑嘌呤片生物等效性研究技术指导原则 |
2024/5/14 |
|
33 |
2024年第23号 |
利丙双卡因乳膏生物等效性研究技术指导原则 |
2024/5/14 |
|
34 |
2024年第23号 |
硫辛酸片生物等效性研究技术指导原则 |
2024/5/14 |
|
35 |
2024年第23号 |
依帕司他片生物等效性研究技术指导原则 |
2024/5/14 |
|
36 |
2024年第23号 |
依托咪酯中/长链脂肪乳注射液生物等效性研究指导原则 |
2024/5/14 |
|
37 |
2024年第23号 |
乙酰半胱氨酸颗粒生物等效性研究技术指导原则 |
2024/5/14 |
|
38 |
2024年第24号 |
中药改良型新药研究技术指导原则(试行) |
2024/5/15 |
|
39 |
2024年第25号 |
在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则 |
2024/5/30 |
|
40 |
2024年第26号 |
化学药品注射剂配伍稳定性药学研究技术指导原则(试行) |
2024/6/12 |
|
41 |
2024年第28号 |
化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则 |
2024/6/12 |
|
42 |
2024年第29号 |
《已上市化学药品药学变更研究技术指导原则(试行)》原料药变更的问答 |
2024/6/13 |
|
43 |
2024年第29号 |
已上市疫苗药学变更研究技术指导原则(试行) |
2024/6/14 |
|
44 |
2024年第29号 |
临床试验期间生物制品药学研究和变更技术指导原则(试行) |
2024/6/14 |
|
45 |
2024年第31号 |
药物临床试验不良事件相关性评价技术指导原则(试行) |
2024/6/14 |
|
46 |
2024年第32号 |
慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则 |
2024/6/21 |
|
47 |
2024年第33号 |
中药口服制剂生产过程质量控制研究技术指导原则(试行) |
2024/6/24 |
|
48 |
2024年第34号 |
化学仿制药注射剂过量灌装研究技术指导原则 |
2024/7/5 |
|
49 |
2024年第35号 |
化学药品仿制药口服溶液剂药学研究技术指导原则 |
2024/7/8 |
|
50 |
2024年第37号 |
胃食管反流病治疗药物临床试验技术指导原则 |
2024/7/17 |
|
51 |
2024年第38号 |
地舒单抗注射液生物类似药(肿瘤适应症)临床试验指导原则(试行) |
2024/9/19 |
|
52 |
2024年第39号 |
治疗慢性心力衰竭药物临床试验技术指导原则 |
2024/9/19 |
|
53 |
2024年第40号 |
复方甘草酸苷片生物等效性研究技术指导原则 |
2024/9/25 |
|
54 |
2024年第40号 |
地屈孕酮片生物等效性研究技术指导原则 |
2024/9/25 |
|
55 |
2024年第41号 |
疫苗免疫原性桥接临床试验技术指导原则(试行) |
2024/9/25 |
|
56 |
2024年第42号 |
抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则 |
2024/10/10 |
|
57 |
2024年第44号 |
氟[18F]化钠注射液仿制药药学研究技术要求(试行) |
2024/10/22 |
|
58 |
2024年第45号 |
可复制型慢病毒检测共性问题与技术要求 |
2024/10/29 |
|
59 |
2024年第46号 |
司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则 |
2024/11/1 |
|
60 |
2024年第47号 |
抗体偶联药物分段生产试点注册申报技术要求 |
2024/11/7 |
|
61 |
2024年第48号 |
基于疾病登记的真实世界数据应用指导原则(试行) |
2024/11/12 |
|
62 |
2024年第49号 |
细胞治疗产品临床药理学研究技术指导原则(试行) |
2024/11/19 |
|
63 |
2024年第50号 |
替代或者减去已上市中药处方中濒危药味研究技术指导原则(试行) |
2024/12/11 |
|
64 |
2024年第50号 |
濒危动物类中药材人工制成品研究技术指导原则(试行) |
2024/12/11 |
|
65 |
2024年第54号 |
药物临床试验样本量估计指导原则(试行) |
2024/12/23 |
|
66 |
2024年第53号 |
模型引导的创新药物剂量探索和优化技术指导原则 |
2024/12/23 |
|
67 |
2024年第52号 |
疫苗临床试验统计学指导原则(试行) |
2024/12/23 |
|
68 |
2024年第51号 |
多糖结合疫苗药学研究及评价技术指导原则(试行) |
2024/12/23 |
|
69 |
2024年第56号 |
评价胰岛素类药物药代和药效动力学的正葡萄糖钳夹试验指导原则 |
2024/12/31 |
|
70 |
2024年第57号 |
腺相关病毒载体基因治疗产品非临床研究技术指导原则 |
2024/12/31 |
|
71 |
2024年第58号 |
嵌合抗原受体T细胞治疗血液淋巴系统恶性肿瘤临床试验技术指导原则(试行) |
2024/12/31 |
|
72 |
2024年第59号 |
预防用猴痘疫苗临床试验技术指导原则(试行) |
2024/12/31 |
|
73 |
2024年第60号 |
脑膜炎球菌疫苗临床试验技术指导原则(试行) |
2024/12/31 |
附件9 2024年药审中心开展的培训
2024年药审中心开展的培训药审云课堂
|
序号 |
培训时间 |
期数 |
培训内容 |
参加人数 |
|
1 |
2024年1月8 日 |
药审云课堂第一期 |
一般性技术问题咨询总体情况介绍 |
10000余人 |
|
化学仿制药一般性技术问题咨询分析 |
||||
|
受理相关一般性技术问题咨询 |
||||
|
申报资料接收与管理相关一般性技术问题 |
||||
|
2 |
2024年2月2日 |
药审云课堂第二期 |
化药药学补充申请常见问题解析 |
10000余人 |
|
临床试验期间生物制品药学研究和变更技术指导原则 |
||||
|
药品注册申请电子申报资料制作软件使用介绍 |
||||
|
药品注册申请电子申报的新要求介绍及常见问题解答 |
||||
|
药品注册申请电子申报资料接收有关要求及注意事项 |
||||
|
《M4 模块一行政文件和药品信息》基本要求及常见问题 |
|
序号 |
培训时间 |
期数 |
培训内容 |
参加人数 |
|
3 |
2024年3月1 日 |
药审云课堂第三期 |
化学仿制药原料药工艺研究常见问题分析 |
11000余人 |
|
化学仿制药制剂处方工艺研究常见问题分析 |
||||
|
化学仿制药质量对比研究常见问题分析 |
||||
|
原料药工艺信息表核定要求与常见问题分析 |
||||
|
制剂工艺信息表核定要求与常见问题分析 |
||||
|
质量标准核定要求与常见问题分析 |
||||
|
《2023年度药品审评报告》介绍 |
||||
|
4 |
2024年4月12日 |
药审云课堂第四期 |
古代经典名方药学基本要求 |
11000余人 |
|
关于加快古代经典名方中药复方制剂沟通交流和申报的有关措施 |
||||
|
化学仿制药注册受理基本要求及常见问题 |
||||
|
《化学药品3类注册申请药学自评估报告(原料药)(征求意见 稿)》主要内容解读及填写说明 |
||||
|
《化学药品3类注册申请药学自评估报告(制剂)(征求意见 稿)》主要内容解读及填写说明 |
|
序号 |
培训时间 |
期数 |
培训内容 |
参加人数 |
|
化学药物仿制药生物等效性研究审评要点 |
||||
|
生物等效性研究常见问题分析 |
||||
|
干细胞产品非临床研究技术指导原则 |
||||
|
5 |
2024年5月10 日 |
药审云课堂第五期 |
中药受理审查基本要求及常见问题 |
12000余人 |
|
中药沟通交流临床方面资料要求 |
||||
|
已上市中药生产工艺变更技术要求及常见问题 |
||||
|
已上市中药说明书安全性内容修订 |
||||
|
罕见病酶替代疗法药物非临床研究指导原则解读 |
||||
|
改良型新药研发沟通交流中的临床关注点 |
||||
|
《药品注册研发生产主体合规信息管理与审查指导原则(试 行)》 |
||||
|
6 |
2024年6月7日 |
药审云课堂第六期 |
已上市境外生产药品转移至境内生产的药品上市注册申请申报资 料要求(化学药品)解读 |
7000余人 |
|
生物制品受理审查基本要求及常见问题 |
|
序号 |
培训时间 |
期数 |
培训内容 |
参加人数 |
|
抗体类产品申报上市审评关注点和申报资料常见问题分析与建议 |
||||
|
新药临床研发常见问题 |
||||
|
药物免疫毒性非临床研究技术指导原则解读 |
||||
|
注册核查及检验过程中的共性问题 |
||||
|
7 |
2024年7月5日 |
药审云课堂第七期 |
中药新药临床研究基本考虑 |
6900余人 |
|
化学药及生物制品临床试验技术要求基本考虑 |
||||
|
ICH M3(R2)指导原则及Q&A |
||||
|
《药物临床试验适应性设计指导原则(试行)》 |
||||
|
《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导 原则》 |
||||
|
8 |
2024年8月2日 |
药审云课堂第八期 |
电子申报资料网络传输介绍(2024年7月1 日发布) |
8000余人 |
|
抗肿瘤药药学审评中的共性问题 |
||||
|
ICHS6生物制品的临床前安全性评价 |
||||
|
抗肿瘤药物临床审评中的共性问题 |
|
序号 |
培训时间 |
期数 |
培训内容 |
参加人数 |
|
创新药审评中临床药理常见问题和考虑 |
||||
|
治疗性蛋白药物药代动力学研究常见问题和考虑 |
||||
|
先进治疗药品药学审评常见问题及审评考虑 |
||||
|
9 |
2024年9月6日 |
药审云课堂第九期 |
局部起效化学仿制药体外释放(IVRT)与体外透皮(IVPT)研 究的一般考虑 |
8000余人 |
|
《已上市化学药品药学变更研究技术指导原则(试行)》原料药 变更的问答 |
||||
|
药物上市后变更的非临床研究和评价关注点 |
||||
|
《已上市化学药品和生物制品临床变更技术指导原则》解读 |
||||
|
临床试验期间变更管理及药物临床试验期间方案变更的思考 |
||||
|
《药物临床试验不良事件相关性评价技术指导原则》起草背景及 主要内容简介 |
||||
|
10 |
2024年10月11日 |
药审云课堂第十期 |
以患者为中心审评考虑与基本考虑介绍 |
8000余人 |
|
以患者为中心的罕见疾病药物研发试点工作-“关爱计划”的介绍与 申报说明 |
||||
|
关于罕见病药物的非临床研究评价相关考虑 |
|
序号 |
培训时间 |
期数 |
培训内容 |
参加人数 |
|
药品注册申请电子申报常见问题解答 |
||||
|
药品注册核查检验工作的基本考虑 |
||||
|
《化学药品仿制药口服溶液剂药学研究技术指导原则》解读 |
||||
|
11 |
2024年11月8 日 |
药审云课堂第十一期 |
EOP II沟通交流环节药学专业主要考虑 |
9000余人 |
|
EOP II沟通交流环节非临床技术审评考虑 |
||||
|
创新药III期确证性临床试验开展前沟通交流临床审评的关键考虑 |
||||
|
先进治疗药品确证性临床试验开展前沟通交流技术审评考虑要点 |
||||
|
《抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则》解 读 |
||||
|
12 |
2024年12月6 日 |
药审云课堂第十二期 |
化学药品仿制药药学申报资料撰写要求及常见问题(原料药一) |
11000余人 |
|
化学药品仿制药药学申报资料撰写要求及常见问题(原料药二) |
||||
|
化学药品仿制药药学申报资料撰写要求及常见问题(制剂一) |
||||
|
化学药品仿制药药学申报资料撰写要求及常见问题(制剂二) |
线下培训
|
序号 |
培训时间 |
培训主题 |
参加人数 |
|
1 |
2024年4月25 日 |
支持东北医药产业发展药品注册技术系列培训班 |
700余人 |
|
2 |
2024年4月26 日 |
2024年支持京津冀地区医药产业发展药品注册技术系列培训班(化学 药专场) |
700余人 |
|
3 |
2024年5月29 日 |
支持成渝医药产业发展药品注册技术系列培训班(中药、化药专场) |
920余人 |
|
4 |
2024年7月11 日 |
2024年支持京津冀地区医药产业发展药品注册技术系列培训班(生物 制品专场) |
400余人 |
|
5 |
2024年7月25 日 |
支持长三角和大湾区医药产业发展药品注册技术系列培训班 |
1000余人 |
|
6 |
2024年9月12 日 |
支持长三角和大湾区医药产业发展药品注册技术系列培训班(中药专 场) |
1000余人 |
|
7 |
2024年10月17 日 |
支持京津冀地区医药产业发展药品注册技术系列培训班(中药注册研发 专题培训) |
350余人 |
|
8 |
2024年10月24 日 |
支持川渝地区医药产业发展药品注册技术系列培训班(生物制品、放射 药) |
1000余人 |
|
9 |
2024年11月19 日 |
支持长三角和大湾区医药产业发展药品注册技术系列培训班(细胞和基 因治疗)在沪举办 |
700余人 |
|
10 |
2024年11月25 日 |
省局药品上市后变更技术要求培训 |
500余人 |
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。