24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
硬性光学内窥镜(自然孔道类)注册产品是指通过人体自然孔道的方式进入人体的第二类观察用硬性光学内窥镜产品,常见的硬性光学内窥镜(自然孔道类)包括喉镜、鼻窦镜、尿道膀胱镜、宫腔镜、直肠镜等。今天为大家介绍硬性光学内窥镜(自然孔道类)产品技术要求及注册审查要点,一起看正文。
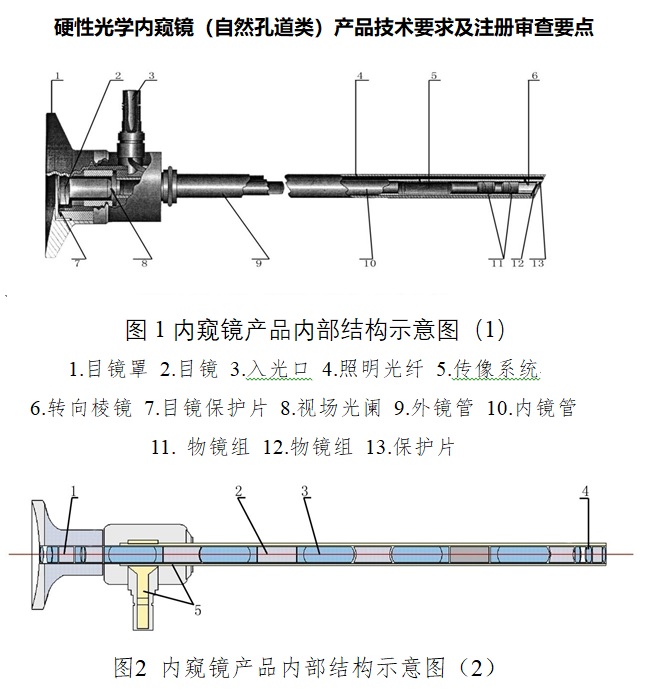
一、硬性光学内窥镜注册单元划分
硬性光学内窥镜(自然孔道类)注册单元划分应符合《医疗器械注册单元划分指导原则》的要求,原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
一般情况下,仅仅是长度、直径、视向角、视场角、工作通道其中的一个或几个参数有差异,可以作为同一个注册单元,若内窥镜之间的差异超出上述范畴,应考虑应划分为不同的注册单元。
列举如下:
(1)内窥镜有源或无源手术器械应与内窥镜划分为不同的注册单元。
(2)不同适用范围的内窥镜应划分为不同的注册单元,如喉镜、鼻窦镜、尿道膀胱镜,原理、结构基本无大变化,每种产品作为一个注册单元。
(3)内窥镜与配合使用的设备(例如冷光源、摄像系统等)应划分为不同的注册单元。
(4)嵌入冷光源的内窥镜、支持特殊光谱用于诊断或治疗的内窥镜以及与上述典型内窥镜光学设计不同的内窥镜(如可变焦内窥镜、短景深内窥镜和可变工作距内窥镜)等特殊内窥镜与普通内窥镜应划分为不同的注册单元。
(5)成像方式不同的内窥镜应划分为不同的注册单元。例如硬性光学镜与硬性纤维镜应划分为不同的注册单元。
(6)是否有光学系统可作为注册单元划分的依据(如直肠镜)。一种产品只是含有导光束、窥视管等,可提供光学照明,没有光学系统,不存在视场角、分辨率等的性能指标;另外一种产品既含有光导束,提供光学照明,又含有光学系统,提供观察和成像途径,这两种产品应作为两个注册单元。
(7)一体式结构和分体式结构内窥镜(如宫腔镜),他们的原(机)理、结构、主要性能、预期目的基本相同,可作为同一注册单元的不同型号产品。
本指导原则仅包括对于内窥镜的要求,可与内窥镜作为一个注册单元的附件,根据具体情况提供相应的注册申报资料。
二、硬性光学内窥镜(自然孔道类)的工作原理
硬性光学内窥镜主要由光学成像系统和照明系统组成。
完整的光学成像系统由物镜系统、传像系统和/或目镜系统三大系统组成。工作原理:被观察物经物镜所成的倒像,通过传像系统将倒像以正像形式传输到目镜,再由目镜放大后,为人眼所观察。为构成不同的视向角,需加入不同的棱镜。不同用途的内窥镜根据使用要求制作成不同的外形、外径、长度,以达到使用所需的要求。
照明传输系统由光导纤维组成。工作原理:将冷光源的光经过光导纤维传输到内窥镜前端,照亮被观察物。
三、硬性光学内窥镜(自然孔道类)产品技术要求及检验报告
3.1申报产品适用标准情况
医疗器械注册申请人需列表说明申报产品可参考的国家标准和行业标准,可参考标准详见附2。
产品适用的标准应为现行有效版,建议注册申请人主动跟踪相关标准的更新情况。
3.2产品技术要求
产品技术要求需参照《医疗器械产品技术要求编写指导原则》(国家药品监督管理局通告2022年第8号)文件进行编制。可参考附3中适用标准,结合产品特征制定,可分为性能要求、电气安全要求、电磁兼容要求(若适用)等。
3.3检验报告
注册申请人应提供产品检验报告,产品检验报告应符合国务院药品监督管理部门的要求,可以是医疗器械注册申请人的自检报告,也可以是委托具有医疗器械检验资质的医疗器械检验机构出具的检验报告。
检验报告的产品名称、型号、生产商等基本信息应与申报一致。应明确检验依据和结论。性能部分应与技术要求中性能部分的要求表述一致,安全部分应全面引用相关强制性标准,依据产品的适用性出具完整报告。检验报告的照片页应反映出产品结构组成、基本外观信息、铭牌信息、重点结构和标识。
如选择典型性型号进行检验,应提交典型性声明,从产品风险与技术角度明确选择典型性型号的依据。性能检验原则上可选择同一注册单元里视场角/视向角最大的、插入部直径最小的、细长比(长度/直径)最大的型号,如含有工作通道的,直径应为插入部外径减去工作通道内径;应选择结构复杂的,特别是光学系统较复杂,容易出现薄弱环节的产品。原因是基于以下例举因素的考量:如视场角较大应注意视场边缘的成像质量;视向角比较大的情况需要验证其成像效果;细长比较大的情况对工艺的要求较高,需要验证其光学和机械性能;有特殊结构设置的产品,如可变视向角的内窥镜,需要对其特殊功能进行验证等。
由同一检验机构对性能、电气安全进行检验的,检验报告应进行关联,检验报告应备注样品一致性以及产品整改情况。由不同检验机构出具对性能、安全进行检验的,应按照《医疗器械注册自检管理规定》提交自检报告及相应的申报资料。
四、硬性光学内窥镜(自然孔道类)注册产品的生物学特性研究
生物学评价报告应体现产品名称和型号,与申报产品对应。内窥镜与人体接触的材质包括镜头、镜体以及胶水(如有)等。应明确与人体接触材料的部件名称、材料名称等信息,提供图示说明与人体接触材料对应的位置。同时应考虑生产工艺及清洁灭菌对生物相容性的影响,考虑设计生产过程中可能引入的污染物、残留物、降解产物、加工残留物影响等。
根据GB/T 16886.1的分类要求,内窥镜预期与人体黏膜短期接触,属于表面接触器械。如需进行生物学试验,通常应考虑细胞毒性、致敏、刺激或皮内反应,有可能接触破裂或损伤表面的则不限于这三项。应对生物学试验情况进行概述。生物学试验可选取典型型号进行,说明典型型号选择依据。生物学试验应最终产品上、或取自最终产品上有代表性的样品上、或与最终产品同样方式加工(包括灭菌)的材料上进行。试验样品应根据注册申请人制定的清洁、灭菌方法进行处理。
如使用其他产品的生物学试验报告,应分析试验产品对申报产品的代表性,就试验产品与申报产品的差异性(材料来源或技术规范、产品配方/工艺/初包装或灭菌、运输贮存条件、预期用途、不良生物反应等)对生物相容性的影响进行评价,如评价资料不足以证明申报产品的生物相容性,应重新开展生物学评价。
与已上市产品相比,如内窥镜中采用新的材料,应在评价资料中详述其理化性能和生物学特性。如豁免生物学试验,可参考《关于印发医疗器械生物学评价和审查指南的通知》中的附2出具评价报告。
对插入人体的金属材料,若采用国家或行业标准中适用的医用金属材料,可不再重复生物学试验。注册申请人应在生物学评价报告中标明所采用国家或者行业标准现行有效版本的标准号(含年号)及名称,所选材料的牌号或/和代号,以及材料的化学成分要求。金属材料的化学成分应通过试验来验证。
如有喉镜、鼻窦镜、尿道膀胱镜、宫腔镜、直肠镜等硬性光学内窥镜注册咨询服务需求,欢迎您随时方便与北京飞速度医疗科技有限公司联络,联系人:施先生,电话:19103801095,微信同。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。