24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
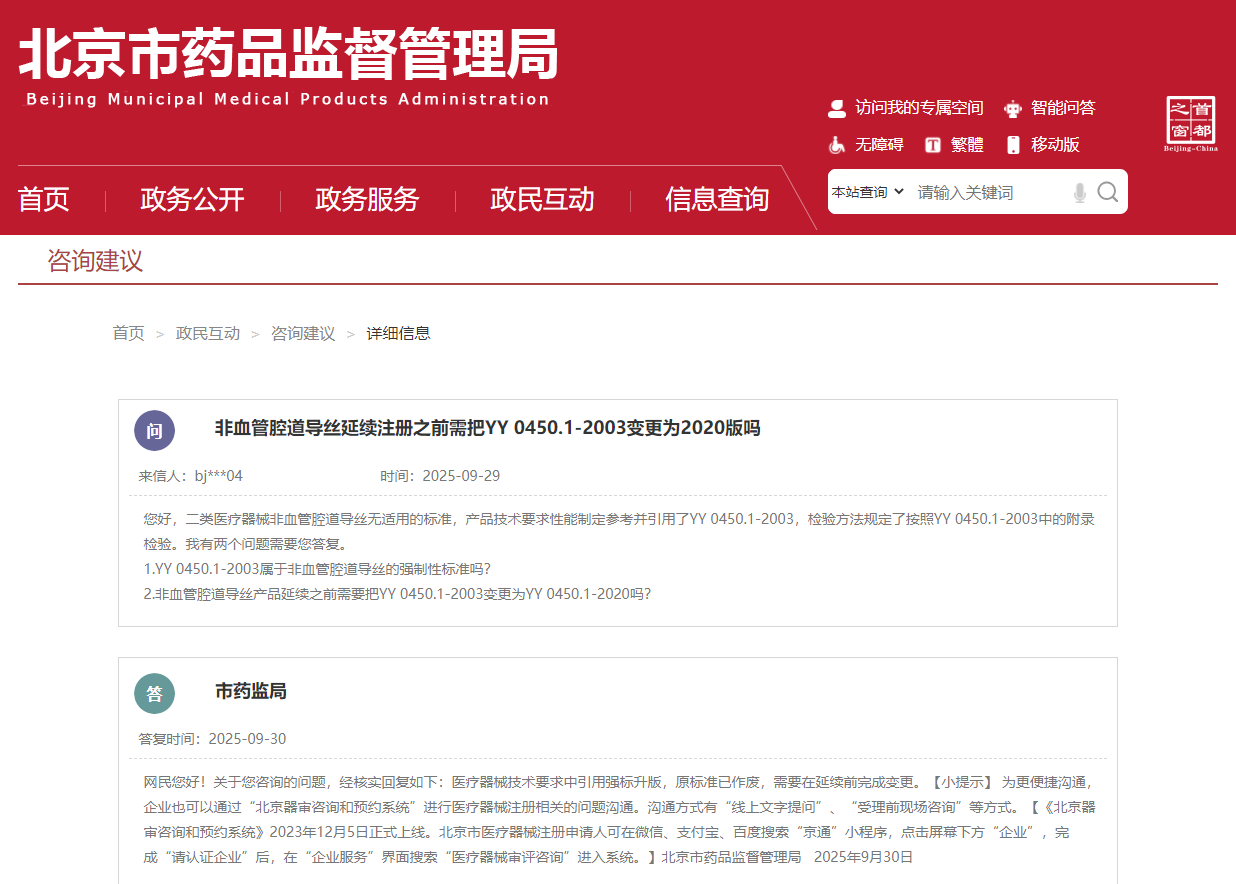
身为肩负医疗器械注册职责的专业人员群体,在日常工作进程当中,经常会遭遇由于各类标准不断更新而相应引发的延续注册方面系列问题。就今天而言,将着重针对非血管腔道导丝于其延续注册整个流程里面所面临的涉及YY 0450.1这一具体标准发生变更的相关问题来展开详尽且深入的探讨,尤其特别针对您所提出的那两个极为具体的问题,会结合与之相关联的诸多法规条例以及现实实际情形来展开深度分析工作,从而尽力为您在后续展开的延续注册这项重要工作提供具备清晰指引意义的相关内容。
YY 0450.1标准性质的界定
关于您所询问的那第一个问题即YY 0450.1 - 2003究竟是不是属于非血管腔道导丝方面的强制性标准这一疑问,从国家药品监督管理局对外所公布出来的那些信息角度去观察,会发现YY 0450.1 - 2020《一次性使用无菌血管内导管辅件第1部分:导引器械》它是被明确标注成为强制性行业标准的,而这个后来出现的标准实际上是将之前存在的YY 0450.1 - 2003版本给替代掉的情况。。
但在此处特别需予以关注的一个关键点在于,虽说该标准自身具备强制性这一特性,然而其主要针对血管内导管辅件里的导引器械加以规范;就非血管腔道导丝产品这一方面而言,情形较为特殊,原因是通常情况下非血管腔道导丝并不会被径直涵盖于该标准的适用范围当中,这就表明YY 0450.1 - 2003亦或2020版对于非血管腔道导丝来说,或许并非属于直接适用的那种强制性标准,反而更多地是扮演技术参考的角色;不过,在这个地方有个重要细节是需要引起关注的,若您的产品技术要求里面已经主动对YY 0450.1 - 2003标准进行了引用,那么从注册管理所处的角度来说,您就不得不去遵循该标准的相关要求。
延续注册前的标准更新必要性
现在所要探讨的第二个且更为关键的操作性问题在于,于非血管腔道导丝产品延续注册之前,是否必然要把YY 0450.1 - 2003按照相关要求变更成2020版;毕竟依据《医疗器械注册与备案管理办法》里的详细规定内容可知,一旦医疗器械强制性标准已获修订,那么对于那些申请延续注册的医疗器械来说,要是无法达到新设定的各项要求,延续注册就极有可能不会被批准通过。。
尽管YY 0450.1 - 2003或许并非径直对您的产品有着直接适用性,然而鉴于您已然在产品技术要求里面将这个标准予以引用的状况下,就必须着重去关注由于其版本更新而可能带来的各类影响。从监管具体实践的角度进行审视,对于那些已然注册且在产品技术要求当中引用了已然修订标准的产品而言,为能够符合新的强制性标准所做出的一系列变化,是属于应当办理变更注册这一特定情形的,也即注册人理应先去办理变更注册相关手续,并且要成功获取原审批部门所批准通过的变更注册文件之后,方能够再提出延续注册的申请。换而言之,虽然YY 0450.1 - 2003对于非血管腔道导丝也许并非直接作为强制性标准,但是您于产品技术要求中的主动引用这一行为,导致这个标准的更新与您的产品延续注册之间形成了密切联系,所以在进行延续注册之前就需要完成相应的变更手续。
标准更新涉及的具体工作内容
完成标准变更所涉及到的一系列具体工作里,首要的是依据新标准要求来展开产品技术要求的更新工作,这里面包含着针对YY 0450.1 - 2020新版本跟2003旧版本之间所存差异的细致分析,还要对这些差异会给您产品带来的具体影响做出评估,比如像YY 0450.1 - 2020这样的新版标准,也许会在性能要求方面或者测试方法领域等出现新的相关规定,而这些规定则是需要逐一去进行谨慎评估的。接下来所要开展的工作需涉及到与之对应的验证环节,而当具体的检验方法所引用参照的是归属在2003年标准体系下的附录部分时,那么就更需依据新标准所设定的诸多要求,去针对该方法展开细致入微的验证工作或者实施补充性质的检验流程。
依据《医疗器械注册与备案管理办法》可知那种已注册产品为契合新的强制性标准而做出的变化被视为应当办理变更注册的情形这就意味着需准备变更注册申请并提交像是详细变更依据及验证资料还有更新后的产品技术要求这般的申报资料且在整个进程当中对于时间节点问题要予以密切关注以此确保标准变更工作与产品延续注册的时间安排能够得以协调以免因标准更新工作出现延误进而影响到延续注册申请。
实际操作中的注意事项
在整个实际操作流程不断推进的这一过程当中,存在着若干个于各环节而言相当关键且必须要予以特别关注和留意的要点,首当其冲的便是有关时间规划这一至关重要的问题,按照相关规定以及既定流程,医疗器械注册证有效期距离届满尚有6个月之前,就应当积极主动地去开展申请延续注册这一重要工作,而与此同时,关于标准变更此项重要工作,则必须要在申请延续注册这个时间节点到来之前妥善完成。
基于此情形下因而需对时间进行合理规划安排,以保障于申请延续注册这一操作之前,标准的变更工作能够得以顺利完成;就技术细节这方面展开考量,作为新版标准的YY 0450.1 - 2020,相比起2003版本有可能出现显著的技术要求上的变动,这些变动对产品安全性以及有效性所造成的影响需被仔细评估,同时进行充分的验证。针对产品性能指标的制定,即便YY 0450.1并非属于直接适用的那种强制性标准,然而只要在产品技术要求里对它有所引用,便需要确保产品符合最新版本的标准相关要求。最后,还不得不对法规政策的最新动态予以关注,及时去了解药监部门关于标准实施的具体要求以及过渡期所施行的政策,使得自身的注册工作能够契合最新的监管要求。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。