24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
供齿状线上粘膜选择性切除用的一次性使用肛肠吻合器在我国属于第二类医疗器械注册产品,一次性使用肛肠吻合器根据钉仓排列不同分为 A 型和 B 型两种型号,A 型为二排钉, B 型为三排钉,由抵钉座、定位杆、钉仓套、指示标牌、活动手柄、保险钮、固定手柄、调节手柄、垫刀圈、吻合钉、环形刀组成;根据钉仓套外径尺寸分为 32、34、36 三种规格;根据带附件型式不同分为Ⅰ型、Ⅱ型,Ⅰ型由窥视套、支撑 套、肛塞和钩线棒组成,Ⅱ型由窥视套、支撑套、肛塞、钩线棒、单孔镜管、双孔 镜管、三孔镜管、镜芯和拨叉组成。产品以无菌状态提供,经环氧乙烷灭菌,一次 性使用。本文为大家介绍一次性使用肛肠吻合器注册审评要点。
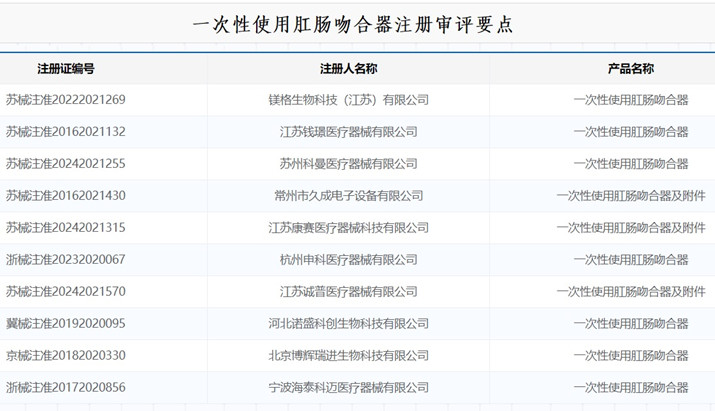
一次性使用肛肠吻合器注册审评要点
(一)一次性使用肛肠吻合器注册产品原理:
一次性使用肛肠吻合器通过挤压活动手柄,通过机械传动装置将预先放置在组件中,呈两排或数排互相平行错位排列的吻合钉击入已经对合好、需要吻合在一起的组织内,将两层组织永久性钉合在 一起,由于缝合钉排列整齐,间距相等,缝合松紧度一致,避免了手工缝合过疏过密和结扎过紧过松等缺 陷,既保证了组织良好的愈合,同时也大大缩短了手术时间。
(二)生物学评价:跟人体组织部位接触,符合生物学评价的要求。
(三)灭菌工艺:该产品采用环氧乙烷灭菌,灭菌工艺经确认和验证,灭菌过程对产品性能不产生影响,灭菌后能达到无菌要求。
(四)一次性使用肛肠吻合器临床评价:
该产品列入《免于临床评价医疗器械目录》,属于免于进行临床评价的医疗器械。将申报产品与已获准境内注册的一次性使用管型痔吻合器、一次性使用三排钉肛肠吻合器进行同品种对比,申报产品与同品种产品在基本原理、结构组成、与人体接触部分的制造材料、性能要求、适用范围、使用方 法、灭菌方式等方面基本等同,差异部分不会对产品的安全性和有效性产生不利影响。
如有一次性使用肛肠吻合器注册或是其它第二类医疗器械注册咨询服务需求,欢迎您随时方便与北京飞速度医疗科技有限公司联络,联系人:吕工,电话:19103801095,微信同。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
上一篇:泌尿封堵取石网注册审评要点
下一篇:电激光生发仪注册审评要点