24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
借助中频电流将药物导入人体的中频药物导入治疗仪,在我国属于第二类医疗器械注册产品,根据《医疗器械分类目录》(2017 年第 104 号公告),其分类编码是09-08-06,本文为大家介绍中频药物导入治疗仪产品工作原理及医疗器械注册要点,一起看正文。
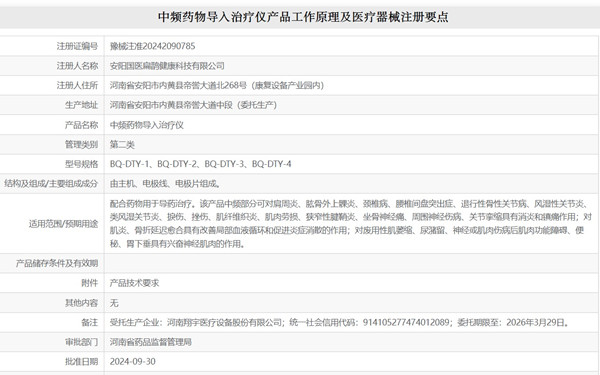
一、中频药物导入治疗仪产品工作原理
中频电流药物导入:中频电流可以提高活性生物膜的通透性。此法兼具中频电疗和药物的综合作用。中频电疗法是应用 频率为 1kHz—100kHz 的交流电(包括正弦波、脉冲波和调制波等)进行治疗、康复的方法。主要治疗作用:(1)镇痛(2)促进局部血液循环(3)促进淋巴回流(4)兴奋神经肌肉(5)提高平滑肌张力作用(6)调节自主神经功能(7)消炎(8)药物离子导入。
二、中频药物导入治疗仪产品注册要点
2.1软件研究
药物导入设备如含有软件组件,应关注是否已按照《医疗 器械软件注册审查指导原则(2022 年修订版)》(2022 年第 9 号 通告)的要求提交软件相关研究资料。如适用,还应关注是否 已按照《医疗器械网络安全注册审查指导原则(2022 年修订版)》 (2022 年第 7 号通告)的要求提交网络安全相关研究资料。
2.2生物学特性研究
依据 GB/T 16886.1 标准中的方法,对药物导入设备中与患者直接或间接接触的部分进行生物相容性评价,一般包括电极 (如适用)、超声治疗头或超声治疗固定贴(如适用)、绑带(如 适用)等。
生物相容性评价研究资料应关注:
(1)生物相容性评价的依据和方法。
(2)产品所用材料的描述及与人体接触的性质。
(3)实施或豁免生物学试验的理由和论证,如该部件/附件 为已注册或备案的医疗器械产品。
(4)对于现有数据或试验结果的评价。 依据 GB/T 16886.1-2022 附录 A《生物学风险评定涉及的终 点》中表 A1 要考虑的评价试验,至少需要做的生物相容性评价试验为细胞毒性、致敏反应、刺激或皮内反应(经粘膜导入适 用)。
可根据《关于印发医疗器械生物学评价和审查指南的通知》 (国食药监械〔2007〕345 号)进行生物学评价。
生物学评价主要对以下内容进行评价:
——医疗器械材料的定性与定量的说明或分析。
——医疗器械/材料与市售产品的等同性比较:比较材料和 产品的用途是否等同;比较两者的生产过程(加工过程、灭菌 过程、包装等)是否相同。
生物性能试验要求应关注以下内容:
——细胞毒性试验:按照 GB/T 16886.5 中规定的方法进行 检验,应≤2 级(定性评价)或无潜在毒性影响(定量评价)。
——刺激或皮内反应:按照 GB/T 16886.10 中规定的方法进 行检验,极性浸提和非极性浸提下应无刺激或皮内反应。
——迟发型超敏反应试验:按照 GB/T 16886.10 中规定的方 法进行检验,极性浸提和非极性浸提下应无迟发型超敏反应。 材料名称相同并不代表材料相同,除非来自同一供应商(即材料的生产商,而非经销商或代理商)。不同的供应商材料的配 方可能存在差异。
三、中频药物导入治疗仪产品技术要求
医疗器械注册申请人可以根据自身产品的特点制定相应的技术要求, 但性能指标不得低于相关国家标准、行业标准的有关要求。如有不适用条款,应在研究资料的性能研究中说明理由。
3.1 应关注产品规格相关信息,可以附录的形式提供,至少包含以下信息:
(1)药物导入设备型号/规格及其划分说明。
(2)对同一注册单元中存在多种型号和/规格的产品,应明确各型号及各规格之间的所有区别(推荐采用图示和/或表格的 方式)。
(3)对包含软件的产品,应明确软件发布版本和软件完整 版本命名规则。
3.2 性能要求 通常应包括物理性能指标,如电刺激性能指标和(或)超 声性能指标,具体根据设备的技术特点而定。
(1)中频药物导入设备,根据《中频电疗产品注册技术审 查指导原则》(2017 年修订版),中频电疗产品应至少包括以下 技术指标的要求:
1)工作频率为 1kHz—100kHz 范围内的单一频率或频段, 频率允差±10%。
2)输出电流:在 500Ω的负载电阻下,输出电流必须不超 过以下的限值:频率≤1500Hz,为 80mA(r.m.s);频率>1500Hz 为 100mA(r.m.s)。
3)输出电流稳定度:不同负载下的输出电流变化率应不大 于 10%。
4)调制频率范围:低频调制中频电疗设备调制频率应在 0-150Hz 范围内。
5)差频频率范围:干扰电治疗设备差频频率应在 0—200Hz 范围内。(如适用)
6)调幅度:低频调制中频电疗设备输出波形应有调幅度指 标,或连续在 0%—100%的调幅度范围内可调,调幅度允差±5%。
7)动态节律:动态干扰电治疗设备的动态节律为 4s—10s。 (如适用)
8)差频变化周期:干扰电治疗设备的差频变化周期为 15s -30s。(如适用)
9)连续工作时间应不少于 4h。
10)设备载波及调制波的频率和波形应加以描述。
11)处方的类型及载波波形应加以描述。
3.3 安全要求
(1)电气安全应符合 GB 9706.1、GB 9706.205(如适用)、 YY 9706.210(如适用)的要求。
(2)电磁兼容应符合 YY 9706.102、GB 9706.205(如适用)、
YY 9706.210(如适用)的要求。
如有中频药物导入治疗仪或是其他医疗器械注册咨询服务需求,欢迎您随时方便与北京飞速度医疗科技有限公司联络,联系人:施先生,电话:19103801095,微信同。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。